Science|从头设计可被小分子“遥控”的动态蛋白
今天想和大家分享一篇刚刚(2026.01.02)发表在 Science 上的工作,来自西湖大学生命科学学院 曹龙兴 老师实验室,联合西湖大学医学院 解明岐 老师团队。

这篇文章做了一件在蛋白质设计领域里被讨论了很多年、但真正系统解决的工作并不多的事——
从头设计一个“会动”的蛋白质系统,并且让这种动态可以被小分子精准控制。
更具体地说,他们不是设计了某个“刚好会变化”的例子,而是构建了一套可复用的蛋白质多聚化“遥控器”:
通过口服小分子药物,按下“开关”,就能让蛋白质按设计好的方式完成组装或解体,而且这一过程在细胞里、甚至在小鼠体内都成立。
这篇文章的意义,并不只在于多了一套好用的合成生物学工具。
它更重要的一点在于:作者从一开始就把“动态”当作设计目标本身,而不是结构之后的附赠品。
下面这篇解读,我想顺着论文的配图,一步一步讲清楚三件事:
他们要解决的难题是什么;
他们是如何把“动态”真正写进设计流程的;
以及这件事,为什么可能会改变我们之后设计功能蛋白的方式。
原文链接:https://doi.org/10.1126/science.ady6017
从“静止”到“变化”:为什么设计一个会动的蛋白这么难?
在蛋白质的世界里,很多关键时刻都不是一个“独角戏”。
病毒入侵细胞时,几个细长的蛋白从不同方向靠近,像对接舱段一样精准咬合,才能打开细胞的大门;
免疫系统被激活时,原本分散的受体蛋白迅速聚拢,像听到号令的士兵,列阵迎敌;
而在细胞内部,一次信号传递往往依赖多个蛋白短暂集结、又迅速解散,把信息一级一级送达。
这些过程的共同点只有一个:
功能发生在变化中,而不是停留在某一个静态结构上。
过去十几年,蛋白质设计领域进展飞快。
我们已经能从头设计出稳定折叠的蛋白,能让它们精准结合靶标,甚至能生成自然界从未出现过的新结构。
但越往前走,一个问题越发明显——
真正难的,从来不是“能不能折起来”,而是能不能按需要动起来。
PART 01|难题:为什么“从头设计动态蛋白”一直这么难?
如果你回顾过去的蛋白质设计工作,会发现一个耐人寻味的事实:
最成功的案例,几乎清一色都是“静态问题”。
设计一个稳定的折叠
设计一个高亲和力的结合界面
设计一个结构固定的功能模块
这些问题,都有一个共同特征:目标是单一结构。
而一旦问题变成——
“这个蛋白需要在两种状态之间切换”、
“只有在某种构象下功能才会打开”、
“构象变化本身就是功能的一部分”,
设计难度就会陡然上升。
原因并不复杂。
第一,动态不是“一个结构的问题”
构象变化意味着什么?
意味着你要同时满足至少两个稳定状态,还要让它们之间存在一条合理、可跨越的转换路径。
这已经不是“结构设计”,而是在设计一个能量景观。
第二,现有工具很难直接处理“变化”
无论是结构预测,还是大多数生成模型,本质上都在回答一个问题:
给定序列,它最可能长成什么样?
但“动态”关心的却是另一个问题:
同一条序列,在不同条件下,能不能稳定存在于不同构象?
这不是多预测几个结构就能解决的事。
第三,“会动”不等于“乱动”
在很多语境里,“动态”常常被简化成“柔性”。
但在真实的生物系统中,关键的动态几乎从来不是随机抖动,而是:
有明确差异的状态
有方向性的转换
有功能后果的切换
换句话说,真正有价值的动态,是可控的状态切换。
破题的关键:先定义“怎么动”,而不是“长什么样”
正是在这样的背景下,曹龙兴老师团队的这篇 Science 把问题摆在了一个非常不同的位置。
他们没有从“我想要一个什么样的蛋白结构”开始,而是先问了一个更根本的问题:
如果一个蛋白的功能依赖构象变化,那这种变化本身,能不能成为设计目标?
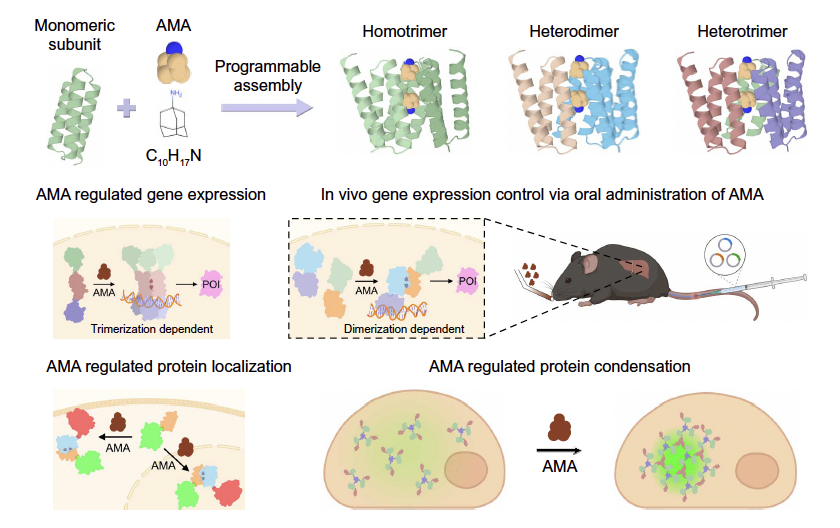
在论文的 Fig.1 中,这个立场被表达得非常直接:
作者关注的不是一个“最好看的结构”,而是同一条蛋白在不同状态下的关系。
两个构象都需要是合理、可折叠的;
构象之间的差异不是随意的;
而它们之间的转换,是整个设计的核心。
这一点看似简单,却几乎决定了后面所有方法选择的方向。
因为一旦你承认:
动态不是结构之后的附赠品,而是设计一开始就要解决的对象,那么,后面的设计逻辑就必须全部重来。
也正是从这里开始,这篇文章真正走上了一条与传统蛋白质设计截然不同的路。
PART 02|方法:他们是怎么把“动态”写进设计流程的?
如果说 Fig.1 解决的是“要设计什么”,那 Fig.2 回答的就是更棘手的问题:
这件事到底怎么做?
在传统的蛋白质设计流程里,步骤往往很清晰:
先选一个目标结构 → 再围着这个结构优化序列 → 最后希望它在现实世界里折成那个样子。
但一旦目标不再是“一个结构”,而是“两个状态及其关系”,这条路就走不通了。
因为你无法简单地告诉模型:
“请同时折成 A 和 B。”
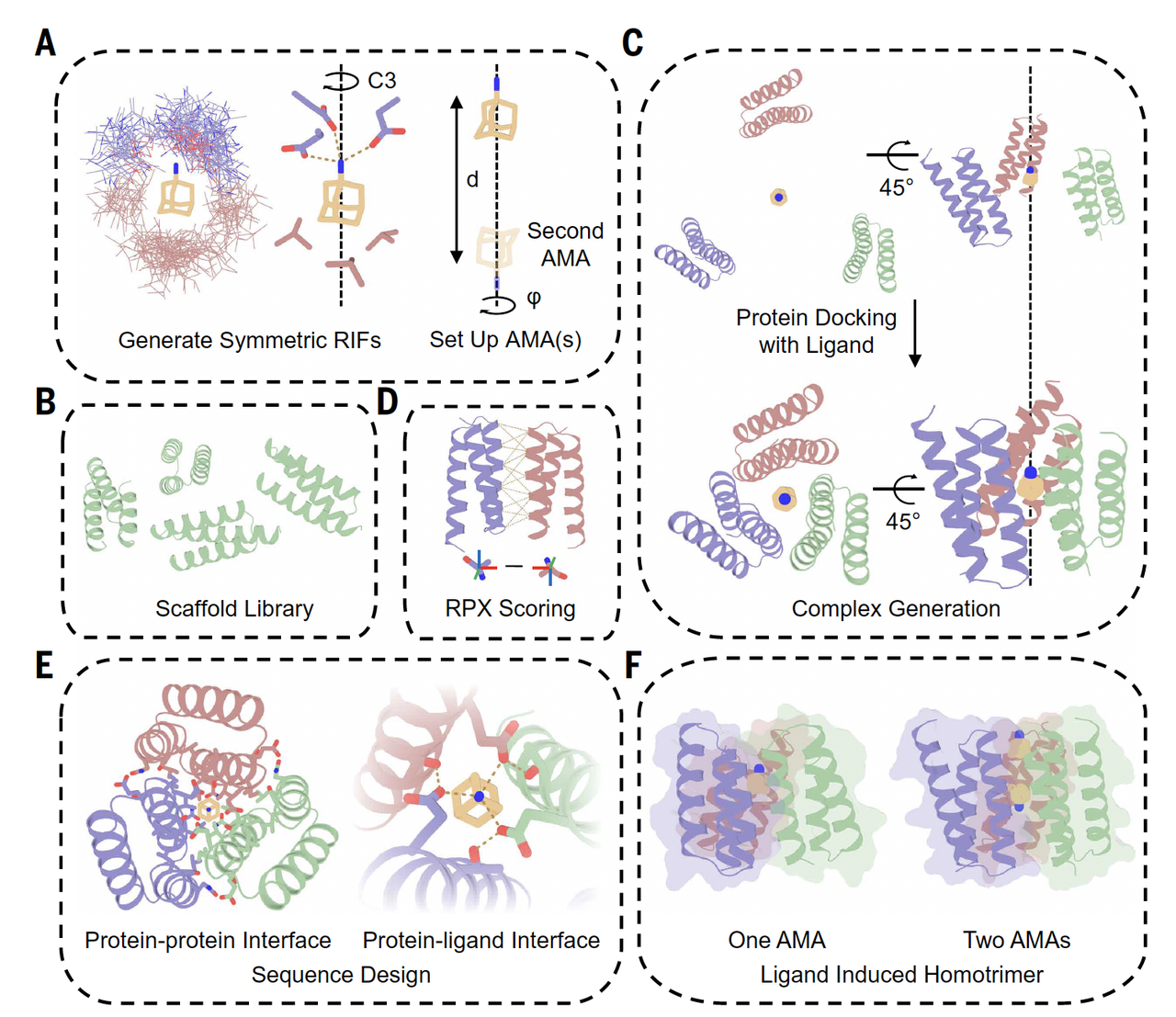
作者在 Fig.2 中做的第一件事,就是彻底放弃“单一目标结构”这个前提。
不再设计“一个答案”,而是设计“一组条件”
从 Fig.2 的示意中可以看到,作者真正给模型的,不是某个确定的三维构象,而是一套约束条件:
哪些区域在两个状态中必须保持相似
哪些区域允许、甚至必须发生变化
变化的幅度大概在什么范围内
哪些相互作用在状态 A 中存在、在状态 B 中消失,反之亦然
换句话说,他们不是在问:
“这个蛋白应该长什么样?”
而是在问:
“有没有一种结构,能同时满足这些互相矛盾、但又被精心定义的要求?”
这一步的转变非常关键。
它把蛋白质设计,从“寻找最优结构”,变成了“寻找满足条件的解”。
动态,被转化成了几何与能量的约束
Fig.2 里还有一个容易被忽略,但非常重要的点:
作者并没有试图直接让模型“理解动态”。
他们做的,是把动态拆解成模型本来就能处理的东西:
空间几何关系
接触与分离
稳定与不稳定
能量偏好
在模型眼里,这不再是“会不会动”,而是“在不同条件下,哪些构象是允许的,哪些是不允许的”。
这种处理方式非常工程化,也非常现实。它承认一个事实:
我们不需要模型真正“理解运动”,只需要它能尊重运动所带来的约束。
为什么这一步很“反直觉”,但又很聪明?
很多人第一次看到这个思路,都会有一个直觉反应:
那不就是给模型加了更多限制吗?会不会更难设计?
恰恰相反。
当你设计一个静态结构时,模型需要在极大的自由空间里寻找一个“最好”的答案;
但当你清楚地告诉它:
哪些地方不能动
哪些地方必须动
动到什么程度算合理
搜索空间反而被压缩到了一个更有意义的范围内。
也正因为如此,作者后面才能设计出一整批满足动态要求的候选,而不是零星的“幸运样本”。
Fig.2 隐含的一条核心逻辑
如果用一句话概括 Fig.2 的方法论,那就是:
不是先设计结构,再希望它有动态;
而是先定义动态,再让结构去满足它。
这句话在读的时候很顺,但在做的时候,其实是一次彻底的范式切换。
它要求设计者放弃对“理想结构”的执念,转而接受:
结构只是实现动态的一种手段。
也正是在这一步之后,这篇文章开始真正和以往的蛋白质设计工作拉开距离。
到这里,我们已经知道三件事:
他们想设计的不是“更柔的蛋白”,而是可切换的状态系统
动态被拆解成了一套可计算、可约束的设计条件
设计目标从“一个结构”变成了“满足条件的解空间”
接下来的问题就变得非常具体了:
按这套方法设计出来的蛋白,真的会按预期在两个状态之间切换吗?
PART 03|结果:设计出来的蛋白,真的在“按设计动”吗?
到这一步,其实读者心里都会有一个共同的疑问:
设计思路听起来很漂亮,但这些蛋白在现实世界里,真的会照着设计那样切换状态吗?
这不是一个多余的怀疑。
在蛋白质设计领域,“设计得通”和“现实中能实现”之间,隔着一条很深的鸿沟。
尤其是当目标从“折叠”升级为“构象切换”,任何一个环节的偏差,都可能让结果彻底失效。
Fig.3,正是作者正面回应这个问题的地方。
先看 Fig.3 在“验证”什么
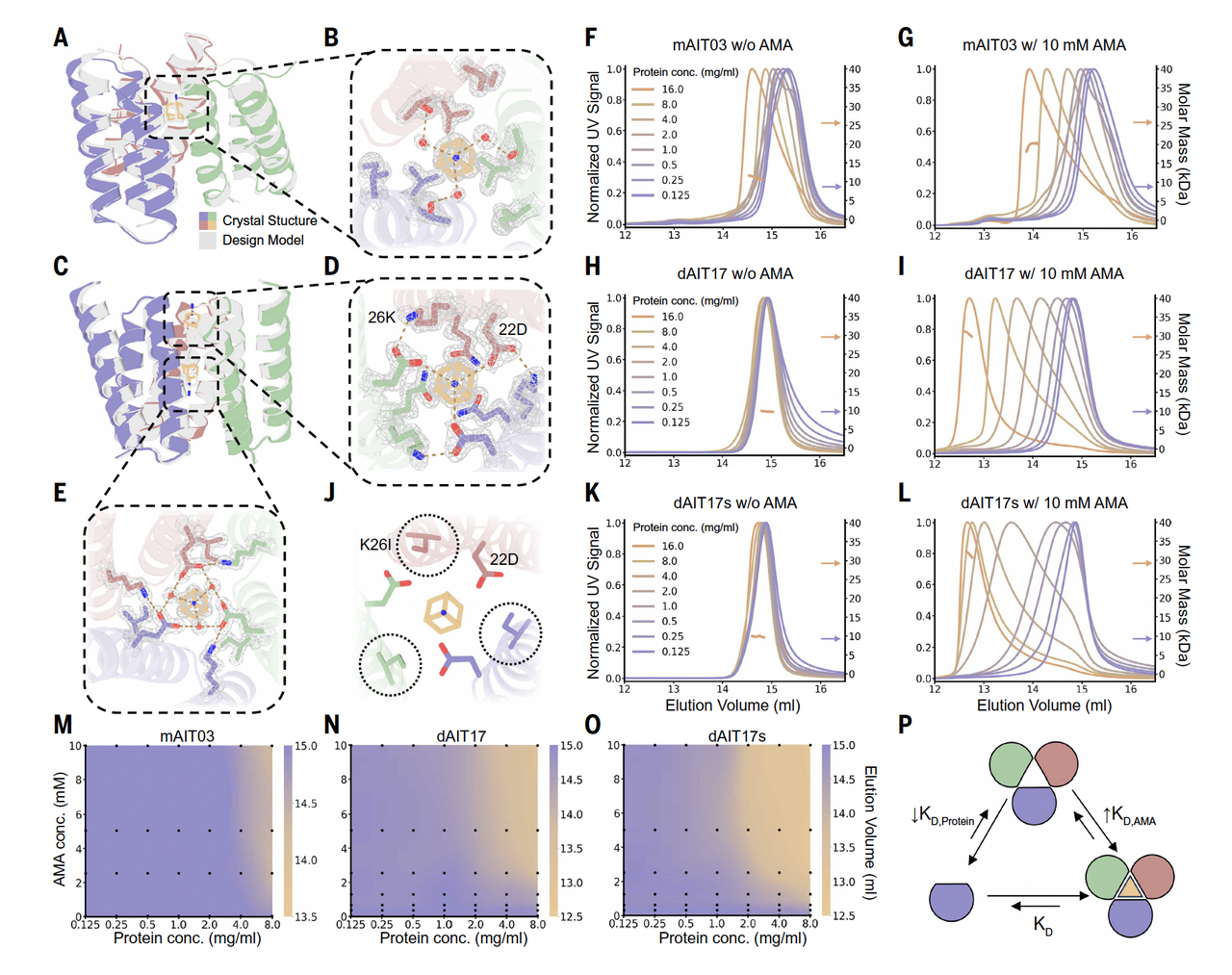
如果你仔细看 Fig.3,会发现作者并没有急着展示复杂的应用或功能,而是非常克制地只做了一件事:
证明这些蛋白,确实存在设计中预期的多种构象状态。
这听起来很基础,但恰恰是最关键的一步。
因为如果连“两个状态”本身都站不住,后面所有关于调控、响应、功能的讨论,都没有意义。
不是“结构不一样”,而是“状态真的可分”
Fig.3 中展示的结果有一个共同特点:
不同构象不是模糊连续的,而是可以清楚区分的。
你能看到:
在不同条件下,蛋白更倾向于稳定在不同的构象
这些构象之间的差异,与设计时定义的变化区域高度一致
而那些被设计为“保持稳定”的区域,确实没有发生无序塌陷
这点非常重要。
它说明模型并不是随意生成了一堆“可能的形状”,而是真的在遵守那套关于“哪里该变、哪里不该变”的约束。
构象变化是“有方向的”,而不是随机漂移
另一个值得注意的细节是:
作者反复强调,这些构象变化并不是不可控的热噪声,而是在预期的构象之间来回切换。
换句话说,蛋白不是在“乱晃”,而是在两个设计好的状态之间做选择。
这正是前面 Fig.1 和 Fig.2 所铺垫的目标:设计的不是柔性,而是可识别的状态切换。
Fig.3 给出的第一个强信号
如果只从 Fig.3 得出一个结论,那会是这一句:
动态,第一次被证明可以作为“设计结果”本身出现,而不是事后观察到的副产物。
这一步虽然不显山露水,但意义非常大。
它说明那套“先定义动态、再让结构满足”的设计逻辑,至少在物理层面是自洽的。
但到这里,作者其实只完成了一半的验证。
因为还有一个更现实的问题在等着——
即便蛋白在体外、在理想条件下能切换状态,这种切换真的能被外界信号精准控制吗?
而这,正是下一部分要回答的。
PART 04|控制:怎样用一个小分子,真正“遥控”蛋白的组装与解体?
到目前为止,作者已经证明了一件事:
他们设计的蛋白,确实能够在不同构象状态之间切换。
但如果动态只能“自发发生”,那它的意义依然有限。
真正让这项工作跨出关键一步的,是接下来的问题:
这种构象变化,能不能被外界信号精准控制?
在生物体系中,最理想的“遥控信号”其实早就写好了答案——小分子药物。
为什么一定要是“小分子”?
Fig.4 之前,作者其实已经做了一个非常现实的取舍。
在所有可能的调控方式里,小分子有几个几乎无法替代的优势:
能口服、能进细胞
起效快、可逆
剂量可控,随时停药
如果真的想把“动态蛋白设计”推向应用层面,小分子几乎是绕不开的选择。
但问题也恰恰出在这里。
难点不在“找一个能结合的小分子”
很多蛋白都能结合小分子。真正困难的是:
让小分子的存在,改变蛋白之间的相互作用方式。
换句话说,小分子不是“塞进一个口袋”,而是要充当一个几何与能量上的枢纽:
有它时,蛋白更愿意组队
没有它时,蛋白就乖乖分开
而且这一切,必须是干净、可逆、可预测的
这对天然蛋白都很难,更不用说从头设计的蛋白。
Fig.4 的关键设计思想:让小分子成为“装配的一部分”
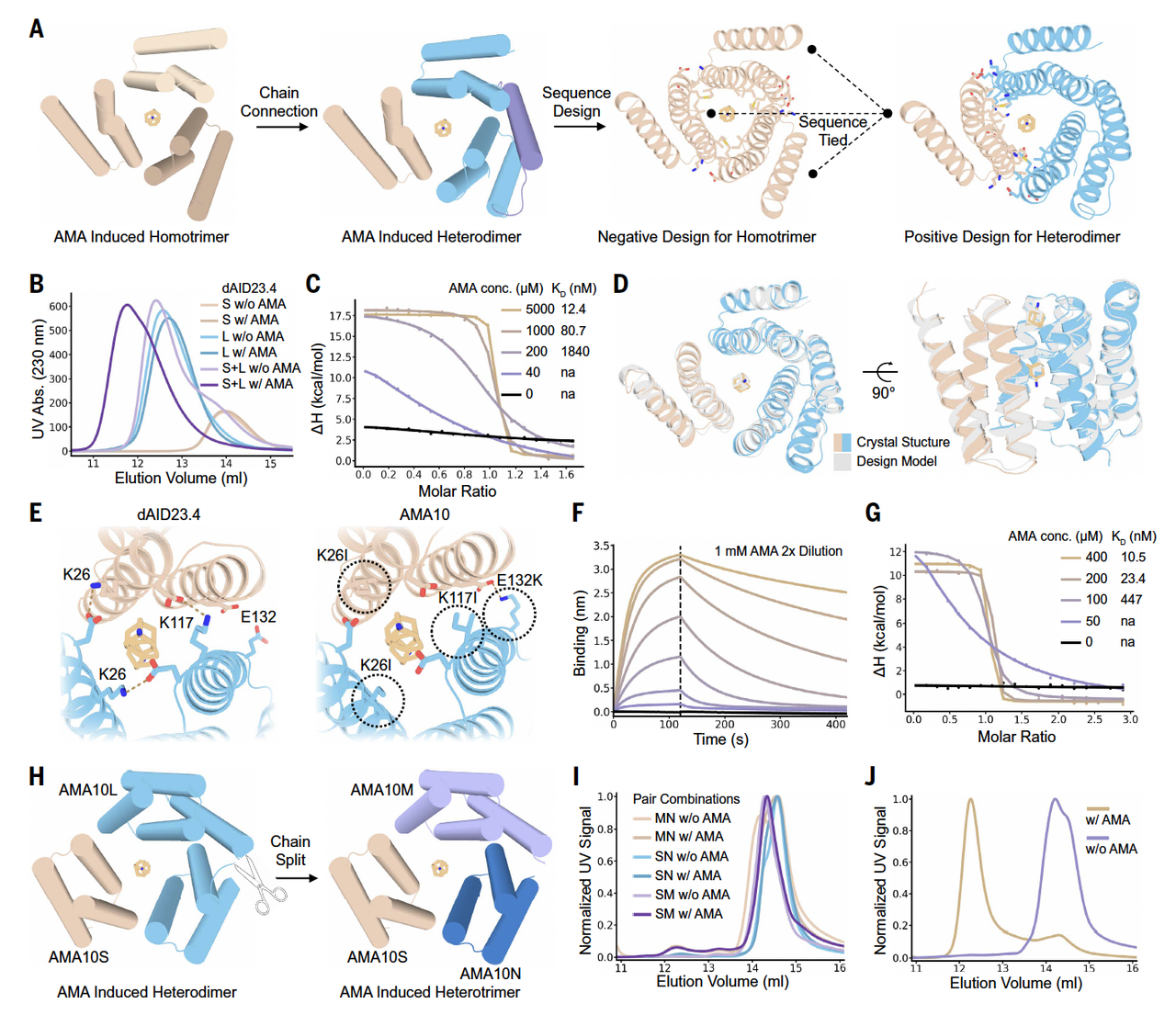
Fig.4 展示的不是一个简单的结合模型,而是一种非常明确的设计策略:
小分子不是外来的调节因子,而是被当作“结构的一部分”写进了设计中。
在作者的设计里:
蛋白单体本身并不会稳定聚在一起
只有当小分子出现时,它们之间的界面才“拼得完整”
小分子相当于补上了装配所需的关键几何与相互作用
这一步非常重要。
它意味着调控不是靠“增强或削弱亲和力”,而是靠改变装配是否在物理上成立。
从二聚体,到三聚体,再到更复杂的组合
Fig.4 中,作者并没有停留在一个“成功案例”上,而是系统性地展示了:
小分子诱导的同源多聚体
小分子诱导的异源二聚体
以及进一步扩展到更复杂的装配形式
这一连串结果传达了一个很清晰的信息:
这不是一次性的设计巧合,而是一套可以复用、可以扩展的设计逻辑。
你可以把它理解成一组“模块”:
设计好的蛋白单元 + 合适的小分子 → 可控的组装行为。
Fig.4 给出的第二个强信号
如果说 Fig.3 证明了“动态可以被设计”,那 Fig.4 则进一步证明了:
动态不仅能被设计,还能被人为操控。
而且这种操控,不是靠极端条件,也不是靠复杂外部装置,而是靠一个现实中已经存在、可口服的小分子。
这一步,已经明显超出了“方法学展示”的范畴,开始触及真正的功能设计。
但作者并没有在这里收手。
因为还有最后一个、也是最严苛的问题:
这些在试管里、在理想条件下成立的“遥控”,在真实的细胞、甚至活体里,还能奏效吗?
PART 05|验证:当“遥控器”进入细胞,甚至进入活体
如果一项蛋白质设计工作,只在试管里成立,其实并不罕见。
真正罕见的是:当你把它放进细胞,甚至放进动物体内,它还能不能按照设计逻辑工作。
作者显然很清楚这一点。
所以在 Fig.5 中,他们把“遥控器”直接推到了一个更严苛的环境里——真实的生物系统。
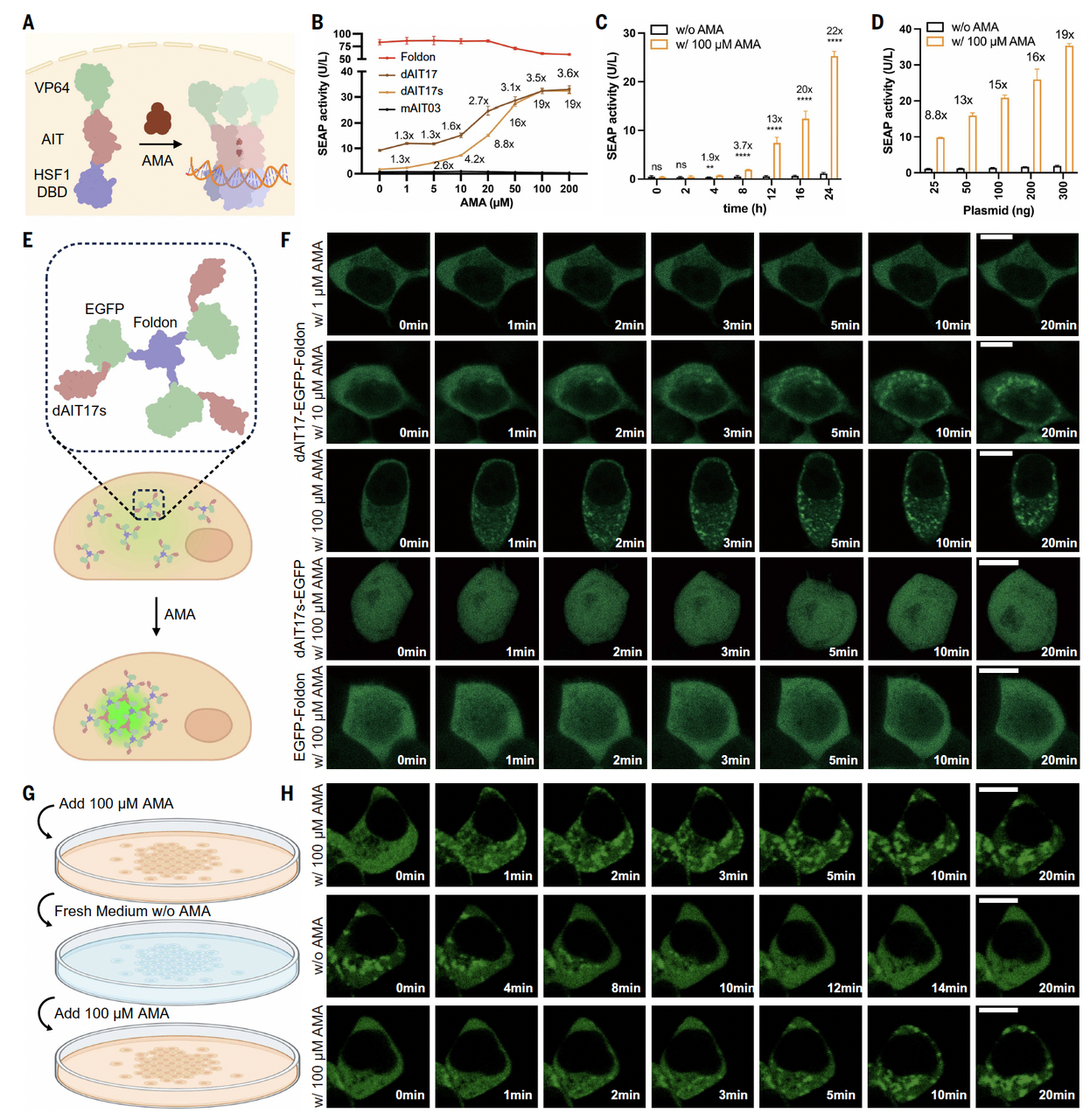
在细胞里:不是“能不能动”,而是“会不会乱动”

Fig.5 的前半部分,展示的是在细胞层面的验证。
这里作者做得非常克制,也非常聪明:
他们并没有一上来就追求复杂功能,而是先验证控制是否干净。
几个关键观察点很清楚:
没加小分子时,系统几乎完全安静
加了小分子后,蛋白迅速组装,信号被激活
整个过程是可逆的,撤掉小分子后,系统回到初始状态
这一点其实比“激活得多强”更重要。
因为在任何调控系统里,漏启动往往比“启动不够强”更致命。
从这些结果来看,这套设计在细胞中表现得非常“守纪律”:
该动的时候动,不该动的时候不乱来。
用“遥控组队”,实现真实功能操作
接下来,作者展示了几种更贴近应用的例子。
他们把这套小分子诱导的组装系统,接到了不同的功能模块上:
用来控制基因表达的开关
用来改变蛋白在细胞内的定位
甚至用来诱导蛋白形成可控的凝聚体
这些实验的共同点不是“花哨”,而是逻辑一致:
无论接上什么功能模块,控制权始终掌握在那一个小分子手里。
这说明“遥控器”本身是一个相对独立、可靠的模块,而不是只能在某个特定场景下工作的“特例”。
到了活体:这是最不讨巧、也最有说服力的一步
真正让这篇文章站得很稳的,是最后一步——动物实验。
作者把这套系统引入小鼠体内,通过口服给药的方式,观察是否能在特定组织中启动预期的生物过程。
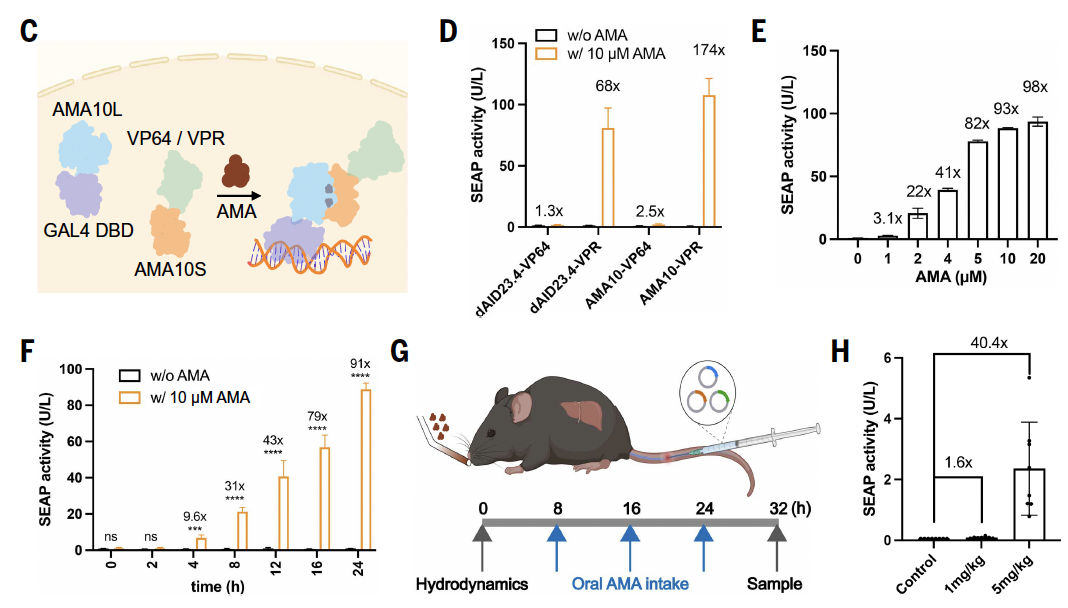
结果非常直接:
小分子给下去,信号就开;不给,系统就关。
这里没有复杂修辞,数据本身已经足够说明问题。
这意味着什么?
意味着这套“遥控器”不是一个只能存在于理想条件下的设计品,而是已经跨过了从概念到系统工具的那道门槛。
Fig.5 隐含的一个重要判断
如果把 Fig.5 放回整篇文章的脉络里,它其实在回答一个非常关键的问题:
从头设计的动态蛋白,能不能承受真实生物环境的复杂性?
作者给出的答案是:至少在这套体系中,是可以的。
而这,也让前面关于“动态作为设计目标”的讨论,真正落了地。
到这里,这篇 Science 的核心证据链已经完整闭合:
动态被明确地定义
被写进设计约束
在体外被验证
被小分子精准控制
并最终在细胞和活体中工作
最后,我们就差一步了。
PART 06|结语:当“动态”成为设计对象,蛋白质设计在变什么?
回头看这篇文章,真正让人印象深刻的,其实不是某一个具体结果——
不是某个蛋白聚成了三聚体,也不是某个小分子成功当了“遥控器”。
而是作者在一开始,就换了一种提问方式。
过去我们常问的是:
能不能从头设计一条蛋白,让它稳定折叠、完成某个功能?
而这篇 Science 问的是:
如果功能本身依赖变化,那这种变化,能不能被直接设计出来?
这两种问题,看起来只差了一点点,但背后的设计逻辑几乎完全不同。
他们真正做成的,不只是一个“工具”
当然,从应用角度看,这套小分子可控的蛋白“组队遥控器”已经足够亮眼:
它安全、可逆、灵敏,还能在细胞乃至动物体内工作。
但如果只把这篇文章理解为“又多了一种合成生物学工具”,其实是低估了它。
更重要的是,作者证明了一件长期被认为“很难系统解决”的事:
动态,不再只是结构设计之后的自然产物,
而是可以被提前定义、被计算约束、被实验验证的设计目标。
一旦这一点成立,很多原本看似“太复杂、太不稳定”的蛋白功能,都会重新变得可被讨论。
从“造结构”,到“造行为”
如果用一句话来概括这篇工作的定位,我会更愿意这样说:
这不是在教我们如何造一个更复杂的蛋白,
而是在教我们,如何开始设计蛋白质的“行为”。
行为意味着什么?
意味着状态、切换、条件、响应。
意味着蛋白质不再只是一个静态零件,而是一个可编程的系统单元。
这一步,可能正是蛋白质设计走向更复杂生命功能之前,绕不开的门槛。
那接下来呢?
文章最后,作者并没有给出过于宏大的承诺。
但顺着这条思路,其实已经能看到很多自然的延伸方向:
更复杂的构象切换
更多类型的小分子输入
多重信号的逻辑组合
以及与真实疾病、治疗场景更紧密的结合
这些都不是“如果有一天”,而是已经站在门口的问题。
也许若干年后再回头看,这篇文章的重要性不在于它设计了哪一套具体系统,
而在于它让越来越多的人开始认真思考一件事:
如果生命活动的本质是动态的,
那蛋白质设计,也该从“静止”走向“变化”。
而这一步,已经有人先走出来了。
延伸阅读
本文属于 AI4S文献 栏目。
返回 AI4S文献 → 去公众号阅读完整版 →