Nature Chemistry|从头设计光响应蛋白:实现可逆组装的分子“光开关”
蓝极说:
在生命世界里,光不仅仅是能量的来源,更是一种无处不在的信息信号。植物通过光来判断昼夜、季节;动物的视觉系统依赖光来感知环境;甚至细菌也能利用光来调控行为。支撑这一切的,就是 光响应蛋白 ——它们能够感知光照,发生构象变化,并进一步触发一系列生命过程。
近年来,科学家们发现,如果能把光当作“开关”,用它来控制蛋白功能,就能实现对生命活动的 精准、可逆、无创调节。这也是光遗传学(optogenetics)兴起的根源。比如常用的 LOV 域、phytochrome,都已经成为光控工具箱里的明星分子。
但是,这些天然光受体有一个共性:它们的架构和机制,受限于进化赋予的天然功能。这意味着,如果我们想要设计出结构更小、更稳定,或者可以执行全新任务的光控蛋白,仅仅改造天然蛋白远远不够。
于是,问题来了:能否从零开始(de novo)设计一种全新的光响应蛋白,既能在特定光照下组装,又能在另一波长光照下解离?

这正是曹龙兴老师团队在刚发表(2025.08.28)在Nature Chemistry上的《De novo design of light-responsive protein–protein interactions enables reversible formation of protein assemblies》这篇文章中要回答的核心问题。
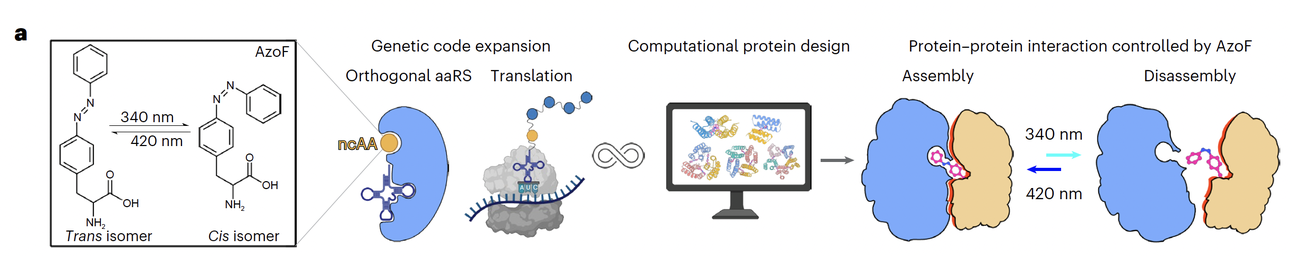
第二部分:设计策略(核心创新)
如果说第一部分是提出问题,那么这一部分就是作者团队给出的“解题思路”。
关键词有三个:非天然氨基酸 AzoF、遗传密码扩展、计算机设计。
首先,作者团队选择了一种“光开关”——phenylalanine-4′-azobenzene(AzoF)。
AzoF 的特别之处在于,它的分子里有一个 偶氮苯基团,在 340 nm 紫外光下会从稳定的 trans 构象翻转成 cis 构象,而在 420 nm 光照或加热时,又能恢复到 trans 状态。这就好比是一个分子级别的“开关按钮”。
接着,研究团队借助 遗传密码扩展技术,把 AzoF 精确地嵌入蛋白界面上。这样,蛋白的组装和解离就完全取决于 AzoF 的构象:
trans 构象:AzoF 体积小巧,能与邻近残基形成紧密疏水作用,帮助蛋白界面“咬合”在一起;
cis 构象:AzoF 变得弯折,产生空间冲突(steric clash),迫使蛋白界面解离。
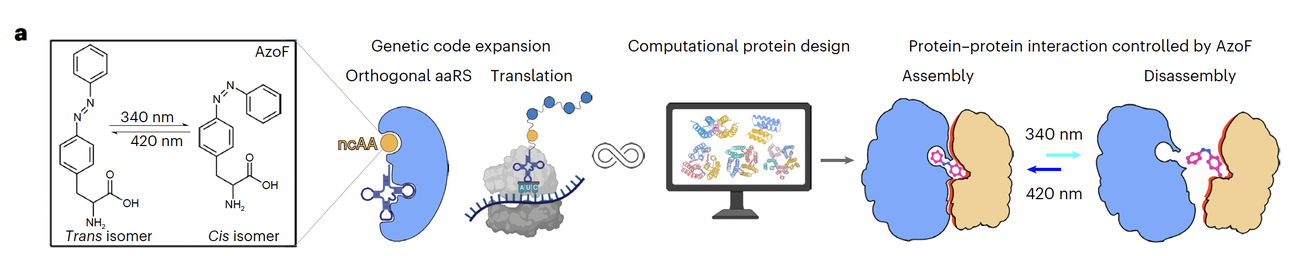
最后,为了确保这一策略能够真正奏效,团队开发了一整套 计算机辅助设计流程(Fig. 1b):
先生成一批三、四螺旋束的蛋白骨架(scaffold);
再在界面位置尝试“植入”AzoF,并快速评估它在 trans 和 cis 构象下的能量与空间匹配情况;
通过蒙特卡洛搜索 + Rosetta + ProteinMPNN 等工具,优化氨基酸序列,确保在 trans 下界面稳定,在 cis 下则产生强烈冲突。
这套流程有一个很巧妙的点:他们不是随意把 AzoF 放进去,而是 在设计阶段就让 AzoF 的空间需求参与“筛选”。这样保证最终的蛋白既能在暗态下稳固组装,又能在光照下可逆解离。
换句话说,这是一次真正意义上的“分子开关内置化”设计。
第三部分:从设计到验证(homo-oligomer 的成果)
设计只是第一步,能不能真的工作,才是检验的关键。
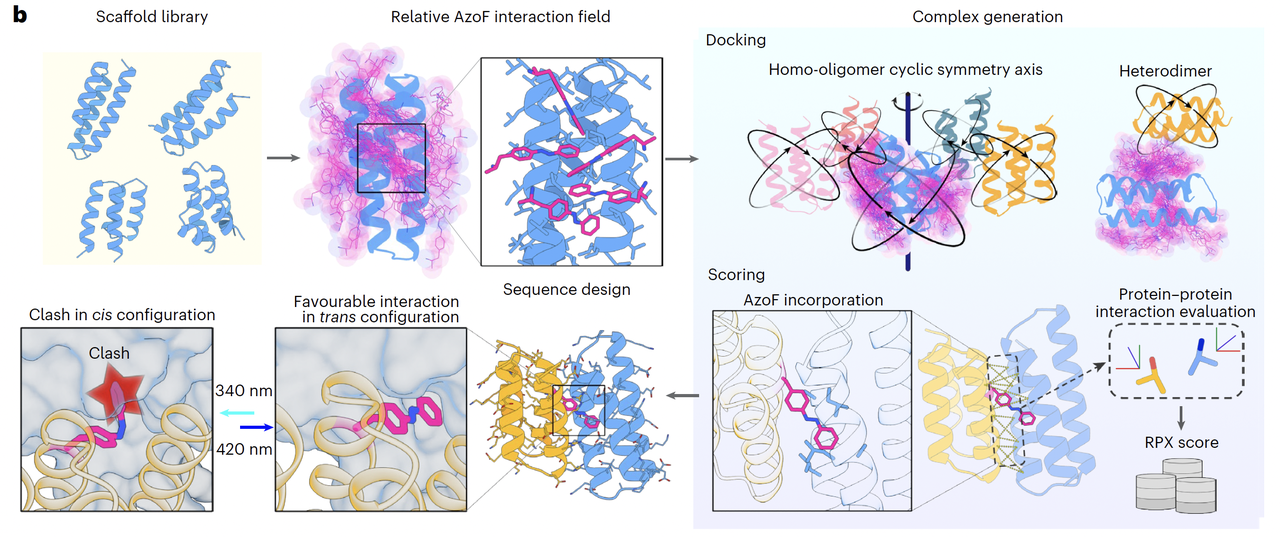
曹龙兴老师团队首先把他们的方法应用在了 环状同源寡聚体(cyclic homo-oligomers) 上,包括二聚体(C2)、三聚体(C3)、四聚体(C4)和五聚体(C5)。
他们一共设计并测试了 200 多个构型,最后有十几个表现出了 明显的光响应特性。
最典型的例子包括:
LRO-C2-5(二聚体)
LRO-C3-7(三聚体)
LRO-C4-13(四聚体)
这些蛋白在 340 nm 光照下能够几乎完全解离成单体,而再照射 420 nm 光,就能恢复到原本的寡聚状态。
这种“可逆组装 ↔ 解离”的效果,就像是一个分子级别的“呼吸循环”。
更令人惊艳的是,团队对这些设计的晶体结构进行了测定(Fig. 2a–b)。
结果发现:实验解析的结构和计算机模型几乎 原子级别吻合,Cα 的均方根偏差(r.m.s.d.)在 1~1.5 Å 左右。这说明,不仅思路可行,设计的精度也达到了非常高的水平。
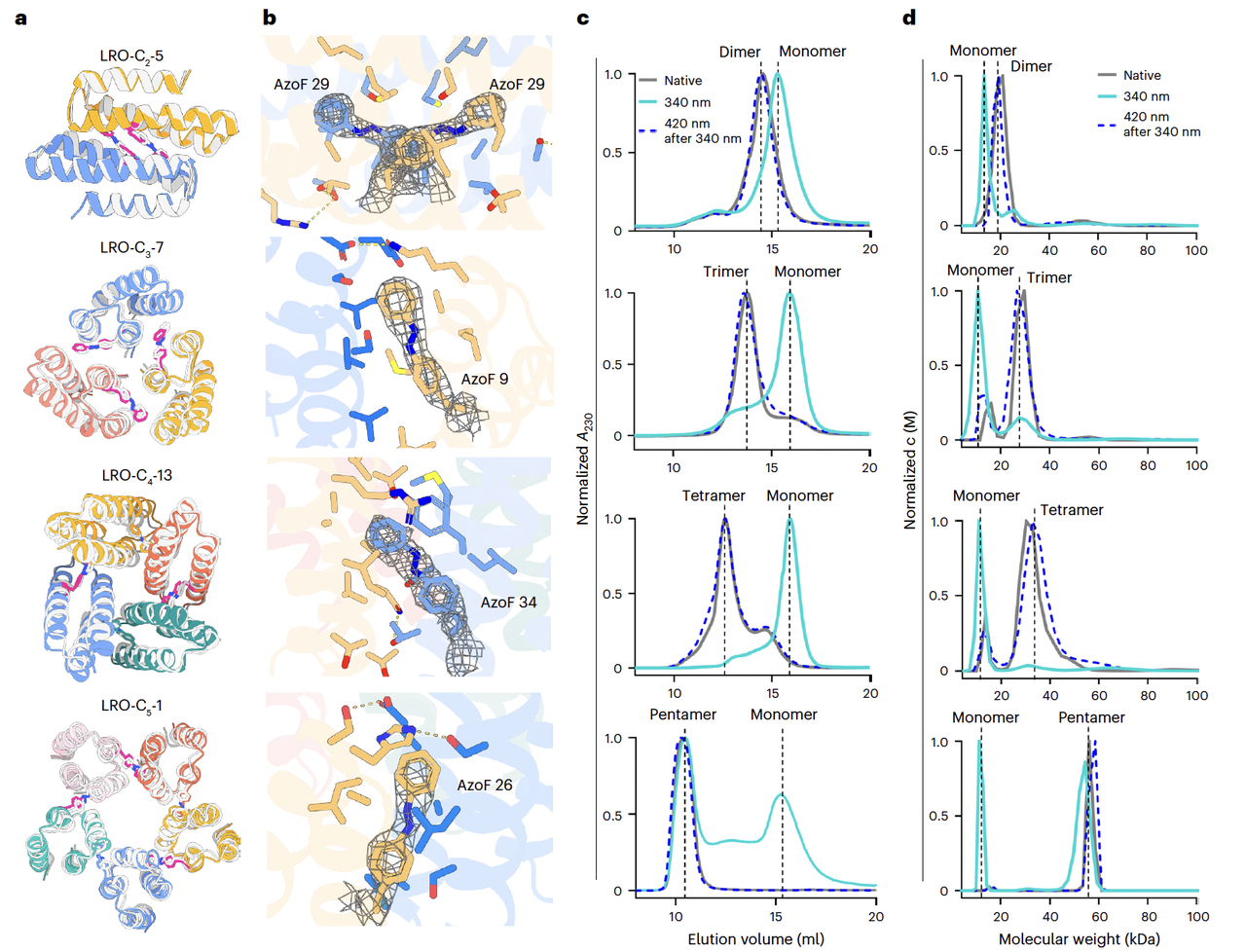
在生物物理层面,他们用 SEC(凝胶过滤色谱)和 AUC(分析超速离心)进一步验证了光响应行为(Fig. 2c–d):
在 trans 构象下,蛋白维持在设计好的多聚体状态;
在 cis 构象下,蛋白解离为单体;
重复光照循环依然能保持稳定的可逆性。
其中一个例子,LRO-C5-1(五聚体),在解离后会部分聚成不规则的复合物。作者分析这是因为它的界面太疏水,解离后容易自发结合。但整体来说,这也揭示了 设计界面疏水性与光响应效率之间的联系。
总结来说,这部分验证了两个关键点:
从头设计的光控蛋白是真的能工作;
设计模型与实际结构高度一致,证明计算设计的可靠性。
第四部分:异源二聚体的突破(heterodimer)
在生物学研究和合成生物学应用中,不同蛋白之间的 特异性结合 往往比同源寡聚更有用。比如,研究者常常需要在细胞内精确地把两个不同的功能模块拉到一起。
为此,曹龙兴老师团队将他们的策略扩展到了 异源二聚体(heterodimer) 的设计。
设计思路是这样的:
其中一条链携带 AzoF(记作 LRD-XA),负责光响应;
另一条链则是普通氨基酸序列(记作 LRD-XV),提供配对界面。
这对组合就像“钥匙和锁”,但开锁与否完全取决于光照。
经过实验筛选,他们得到了几个表现优异的设计,例如 LRD-2、LRD-7、LRD-10。
实验结果显示(Fig. 3c):
在暗态(trans 构象)下,异源二聚体结合紧密;
在 340 nm 光照后,二聚体迅速解离;
再用 420 nm 光,就能恢复原本的结合状态。
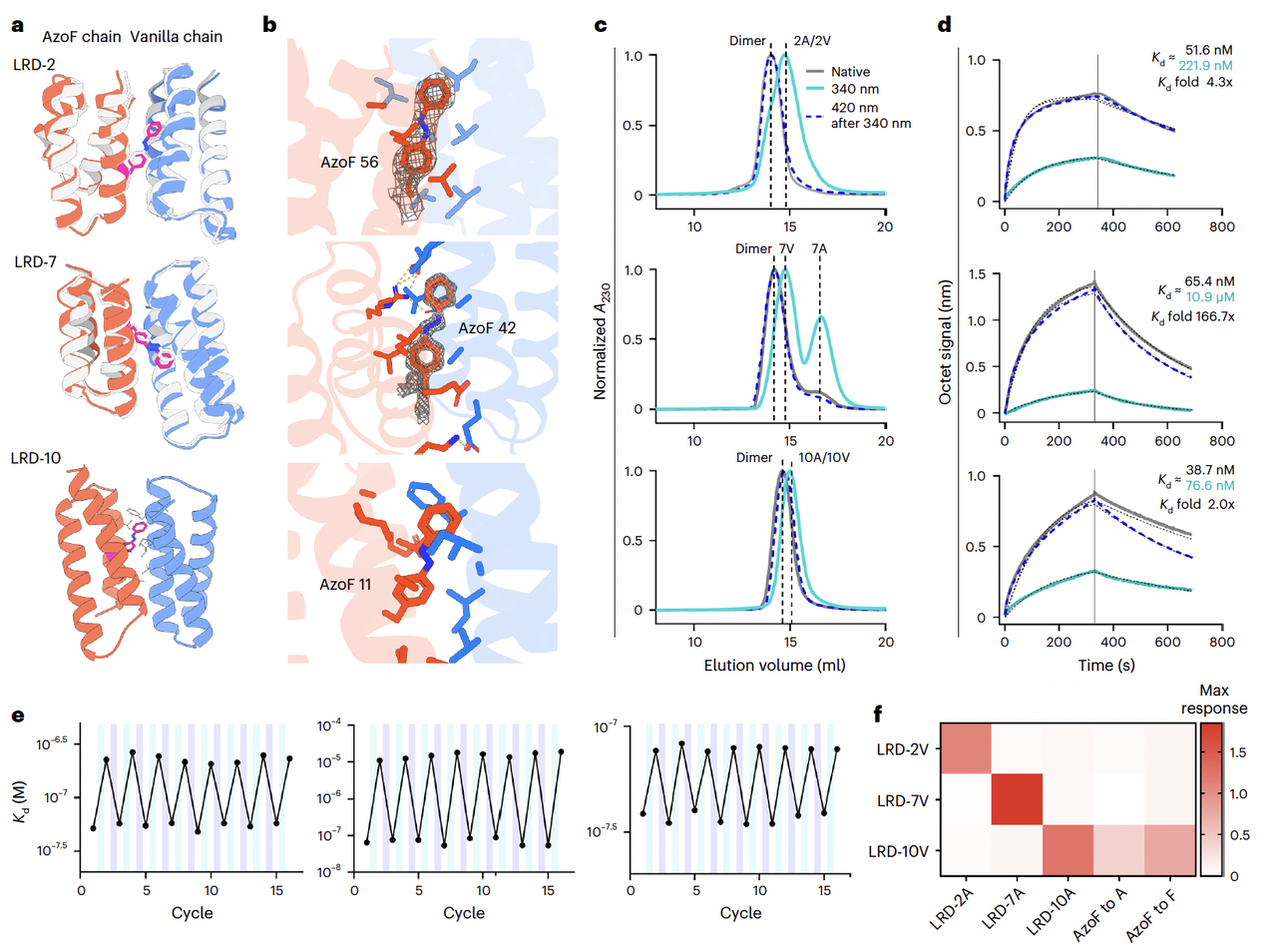
更关键的是,团队用 生物层干涉技术(BLI) 测量了亲和力(Fig. 3d–e):
这些异源二聚体在暗态下亲和力高(纳摩尔级);
光照后,亲和力下降最高可达 167 倍(LRD-7);
这种变化完全可逆,可以在多轮光照循环中稳定重复。
晶体结构进一步证实了 AzoF 的关键作用(Fig. 3a–b)。
比如在 LRD-7 的结构中,偶氮苯的两个苯环甚至能在电子密度图中被清晰分辨出来,和设计模型高度吻合。
另外,团队还测试了特异性(Fig. 3f):
每个 AzoF 链只与对应的 vanilla 链结合;
不会“串门”结合到其他设计。
这种“只认自己对象”的特性,使得这些光控异源二聚体 堪比天然蛋白的特异性。
总结来说,异源二聚体的设计展示了:
光控作用可以精确调节两条不同链的相互作用;
结合力的光控调节幅度可以达到两位数以上;
特异性媲美天然蛋白,为未来的细胞内应用打下了基础。
第五部分:应用展示(从材料到细胞信号)
到这里,前面几部分已经证明:
光控蛋白可以从头设计出来;
它们不仅能组装/解离,还能做到异源二聚体的特异性。
那么,这些分子“开关”能做些什么?
团队给出了两个非常直观的应用展示:材料工程(光控水凝胶) 和 细胞信号调控(光控受体系统)。
- 光控水凝胶 ——“固 ↔ 液”的可逆切换
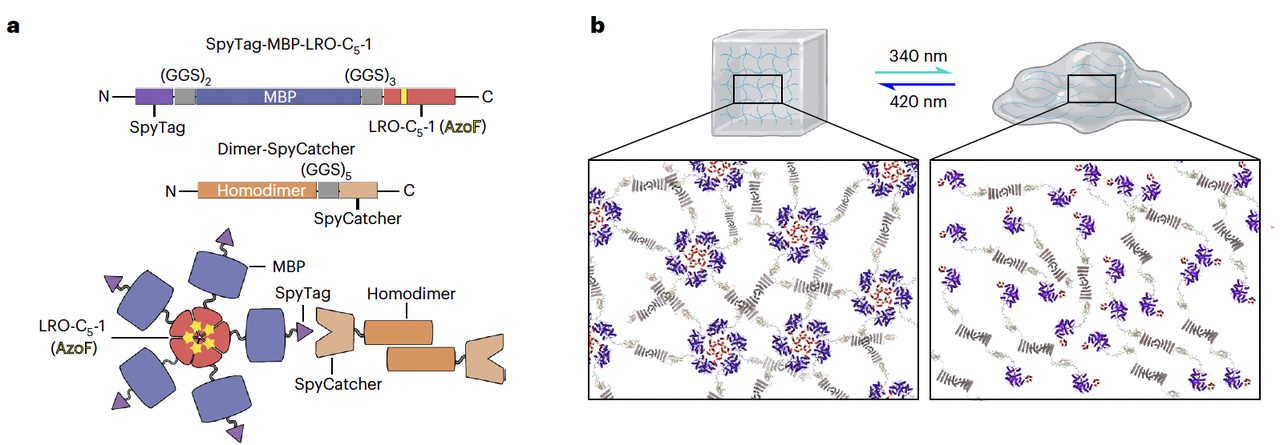
研究团队用 五聚体 LRO-C5-1 作为关键构件,通过 SpyTag/SpyCatcher 技术把它和一个同源二聚体交联,构建成蛋白质水凝胶(Fig. 4a–b)。
实验现象非常直观(Fig. 4c):
在 340 nm 光下,五聚体解离,凝胶塌陷成液体;
在 420 nm 光下,五聚体重组,液体又迅速恢复成凝胶。
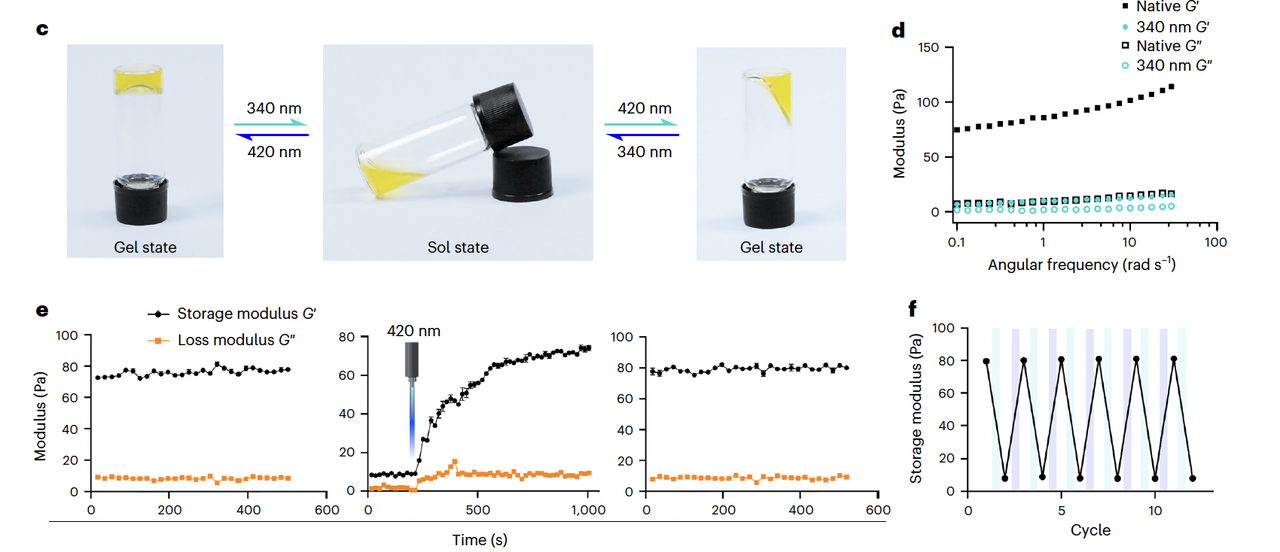
流变学测试(Fig. 4d–f)进一步证明,这个水凝胶的机械性能可以被光照可逆调节,至少能稳定循环 12 次以上。
这意味着研究者们可以用光来控制材料的 流动性和硬度,非常适合在 药物释放、组织工程 等领域应用。
- 光控受体系统 ——精准操纵细胞信号
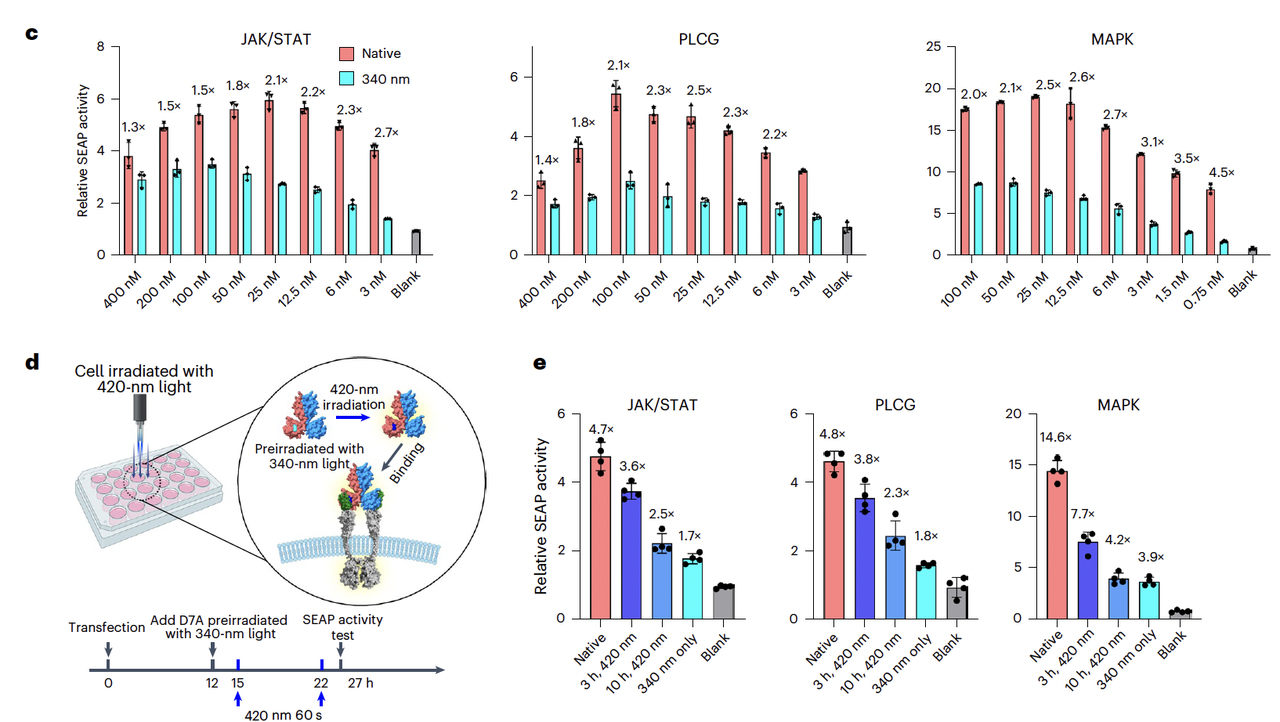
在合成生物学中,如果能用光来控制细胞信号通路,就能实现对细胞行为的时空精准调控。
作者团队基于他们设计的 异源二聚体 LRD-7,构建了一个合成的 配体–受体对(Fig. 5a):
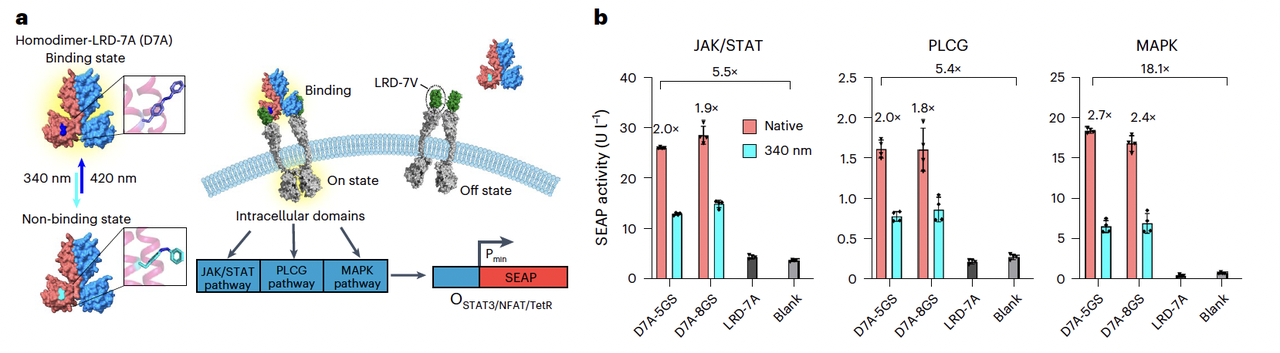
把 “vanilla 链” 融合到 GEMS(Generalized Extracellular Molecule Sensor)受体的胞外部分;
把 “AzoF 链” 设计成二聚化配体。
实验结果非常亮眼(Fig. 5b–e):
在暗态下,配体能触发受体二聚化,激活下游 JAK/STAT、MAPK、PLCG 等信号通路;
在 340 nm 光下,配体解离,信号关闭;
再用 420 nm 光,就能恢复信号;
甚至还能精确控制 信号恢复的时间点,真正实现了“分子开关”对细胞命运的操纵。
小结
通过这两个例子,作者团队展示了 从材料到细胞的跨层次应用潜力:
光控水凝胶,证明了这种设计能用于生物材料与医用材料;
光控受体系统,展示了其在合成生物学和光遗传学中的应用前景。
第六部分:总结与展望
这篇工作展示了一条完整的路线:
从零开始,借助计算设计与遗传密码扩展,把 光响应的非天然氨基酸 AzoF 精确嵌入蛋白界面;
实现了 可逆的、可控的蛋白组装与解离;
验证了同源寡聚体和异源二聚体两种构型,晶体结构与设计几乎原子级吻合;
进一步展示了在 材料(光控水凝胶) 和 合成生物学(光控受体信号) 中的实际应用。
这项研究的意义在于,它不仅仅是“多了一个光控蛋白”,而是提出了一种 新的设计范式:
在分子设计阶段就内置一个可控的“光开关”。
这与过去改造天然光受体的方式完全不同,它为未来打开了更广阔的想象空间。
展望未来,有几个方向尤其值得期待:
扩展非天然氨基酸的种类:不仅限于 AzoF,还可以设计对金属离子、pH、甚至其他小分子敏感的“开关”。
优化光谱特性:通过化学修饰偶氮苯,可以拓展到红光、近红外光等波长,更加适合深层组织应用。
构建复杂的分子机器:将这种光控开关嵌入到更大规模的蛋白复合体中,或许能实现真正意义上的 光驱动纳米机械。
蓝极总结:
这篇文章不仅解决了一个长期存在的挑战(如何从头设计光响应蛋白),还为 光控生物学、合成生物学和生物材料学 打开了新的大门。
延伸阅读
本文属于 AI4S文献 栏目。
返回 AI4S文献 → 去公众号阅读完整版 →