Nature|西湖大学卢培龙团队首次 de novo 设计出跨膜荧光激活蛋白
蓝极说:
在蛋白质设计的世界里,水溶性蛋白早已被频频攻克,但跨膜蛋白一直是个“硬骨头”——结构复杂、难以稳定、几乎无法自由设计。
这次,我想和大家分享的是卢培龙老师团队今年年初发表在 Nature 上的一篇重磅成果:他们不仅成功设计出能点亮荧光的小分子结合蛋白,还让它们稳定地“扎根”在细胞膜里,功能甚至超过了天然膜蛋白。
为什么要读这篇文章?因为它不仅是蛋白质设计的一次技术突破,更像是打开了一扇新大门:未来我们或许可以自由定制跨膜探针、传感器,甚至人工通道和受体。

🔗原文链接:https://www.nature.com/articles/s41586-025-08598-8
1. 为什么这项工作重要?
跨膜蛋白是生命活动中最重要的一类分子之一。它们镶嵌在细胞膜上,负责物质运输、能量转换和信号传递,几乎是“生命的闸门”。如果没有跨膜蛋白,细胞就像一个密不透风的气泡,既无法与外界沟通,也无法维持内部稳态。
但在蛋白质设计领域,跨膜蛋白一直是“硬骨头”。原因在于:
天然跨膜蛋白种类有限,已知结构远少于可溶性蛋白;
在疏水性膜环境中要形成稳定折叠已经很难,更别提在其中“精准凿出”一个能识别小分子的结合口袋;
过去的 de novo 设计尝试,大多只能做到简单的金属离子结合(如血红素),而对小分子非共价识别几乎无人问津。
正因如此,西湖大学卢培龙团队这篇今年发表在Nature的工作才显得格外突破。他们不仅设计出能结合荧光小分子的水溶性蛋白,还进一步把它“跨膜化”,让它在细胞膜中也能稳定工作,并且实现了精准的荧光激活。
这意味着什么?意味着研究者可以像“拼乐高”一样,自主构建一类全新的跨膜传感器,用来成像、检测,甚至未来作为人工通道和受体的基础。
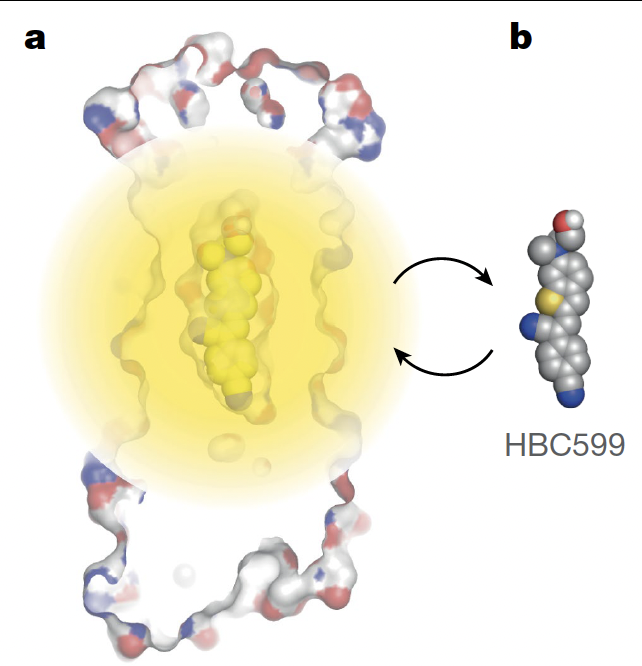
在文章的配图 Fig.1a (上图)中,作者用一张非常直观的示意图告诉我们:他们选择的荧光小分子 HBC,在溶液里是“黑的”,只有当被蛋白紧紧固定成平面构象时才会发光。于是,蛋白设计的挑战就被清晰定义为:如何在一个人工构建的口袋里,把 HBC 分子卡到合适的形状,从而点亮它?
这一张图,就奠定了整篇文章的核心逻辑:从分子识别出发,通过设计实现点亮。
2. 从水溶性 FAP (wFAP) 开始
既然目标是跨膜蛋白,那为什么研究团队没有直接一开始就去设计跨膜蛋白呢?
因为难度太大。于是他们选择了一条“曲线救国”的路线:先在水溶性环境下设计出能点亮荧光分子的蛋白——water-soluble FAP (wFAP),再逐步跨膜化。
2.1 设计路线:迭代式的“人机协同”
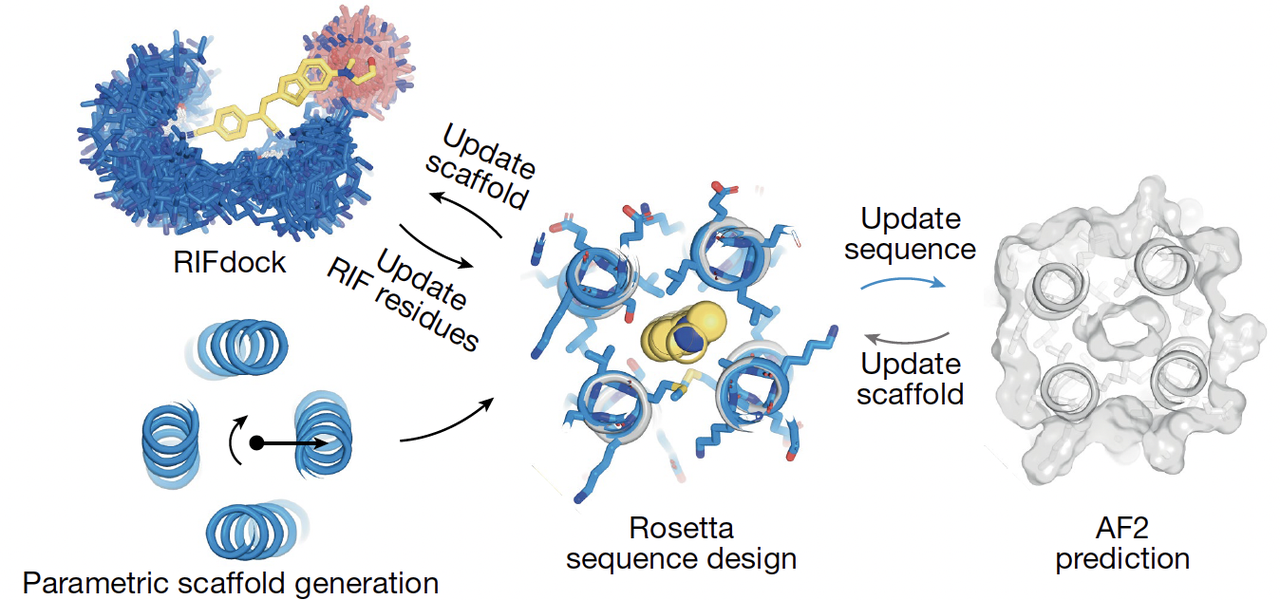
在 Fig.1b 里,作者画出了一个复杂但清晰的设计循环:
骨架生成:先用参数方程生成一系列四螺旋束骨架;
口袋初步对接:把荧光分子 HBC 放入骨架,用 RIFdock 来寻找可能的相互作用;
序列优化:用 Rosetta 优化口袋周围氨基酸的排布;
模型评估:丢给 AlphaFold2 去预测,看看它能否稳定折叠成预期的结构;
反馈修正:如果 AlphaFold2 预测结果和设计不一致,就继续调整序列和骨架,直到收敛。
这一点非常关键:团队没有把深度学习当成“最后的检查”,而是把它嵌入整个循环,形成了 能量函数(Rosetta)+ 深度学习(AF2)双引擎驱动 的设计框架。
2.2 逐步优化:从弱到强
实验结果显示:第一批 wFAP(wFAP0)虽然能点亮 HBC 分子,但效果太弱,不足以在复杂环境下使用。
于是研究者对其进行定向进化和口袋微调,最终得到更优的 wFAP1.1 和 wFAP1.2。
在 Fig.1c–f 中可以直观看到改进的效果:
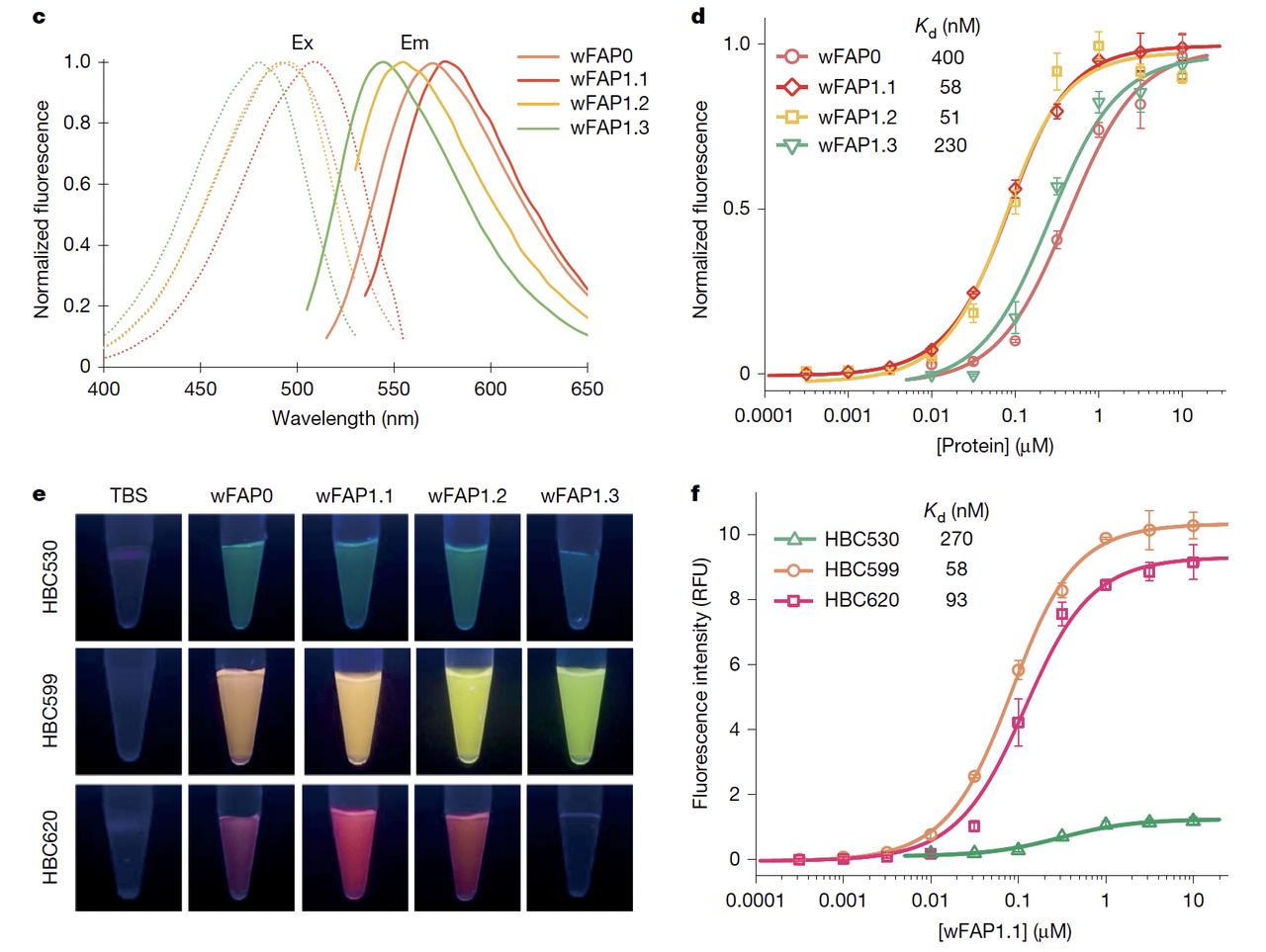
荧光光谱:wFAP1.1 和 wFAP1.2 在 495 nm 激发、570 nm 发射下表现出极高亮度;
结合常数 (Kd):wFAP1.1 对 HBC 的结合达到 58 nM,比 wFAP0 提升了一个数量级;
亮度:wFAP1.1–HBC599 复合物的亮度,已经超过了经典的 GFP。
2.3 科学亮点
这是首次用纯设计手段,构建出一个比 GFP 更亮的人工荧光蛋白;
蛋白的口袋结构和分子对接方式与 AF2 预测高度吻合,说明人工设计真的能和自然折叠“对上号”;
这为跨膜化奠定了坚实基础:先证明口袋能精确设计,再把它迁移到膜环境中。
换句话说,这一步是整个工作的“打地基”:如果没有一个足够稳定、足够亮的 wFAP,后续的跨膜化几乎不可能成功。
3. 跨膜化 → tmFAP 的设计与优化
在水溶性环境里,wFAP 已经表现出强大性能,那么接下来的挑战就是:能不能把它“植入”膜中?
这一步远比想象中困难。
3.1 难点:为什么跨膜这么难?
研究团队首先尝试了一个“直觉方案”:
把 wFAP 的表面氨基酸替换成疏水残基,让它能够镶嵌在膜里。
结果却失败了。原因有二:
跨膜环境要求蛋白表面必须高度疏水,这样的改造往往会破坏原本的四螺旋堆积;
更致命的是,口袋的预组织结构在“表面换肤”后塌陷,无法再稳定结合小分子。
换句话说,直接跨膜化,就像强行把一只金鱼丢进沙漠,它根本活不下去。
3.2 突破:深度学习的“幻觉”方法
于是研究团队转向了更激进的思路——利用 ColabDesign 的 hallucination(幻觉)策略。
这一方法的核心在于:
把 wFAP 的口袋核心固定住,
让深度学习网络去“幻觉”出合适的跨膜序列,
在满足跨膜条件的同时,确保口袋结构不被破坏。
在 Fig.2a–b 中可以直观看到这种思路:
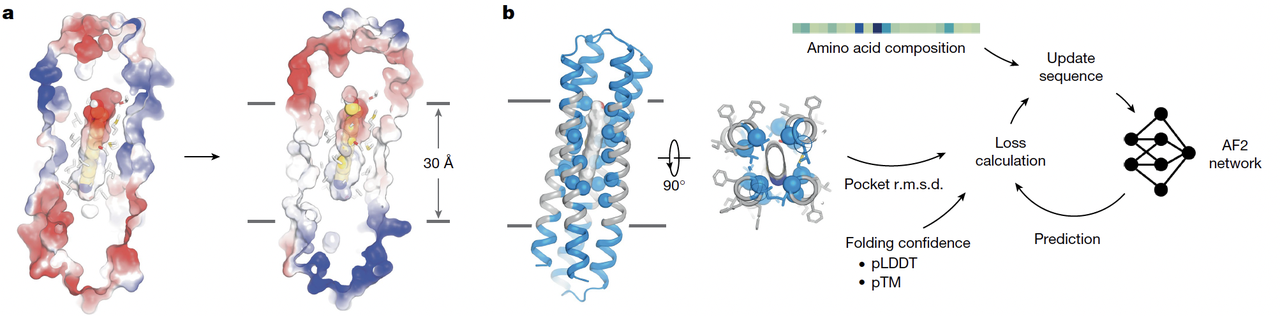
a图左侧是水溶性的 wFAP(表面带电);
a图右侧是跨膜化后的 tmFAP(表面一圈黑色的疏水带,约 30 Å 跨膜跨度);
b图则展示了 hallucination 的工作流:输入骨架,冻结口袋,剩下的交给网络生成。
3.3 成果:点亮 tmFAP
经过这一流程,研究者获得了多个候选 tmFAP,其中 tmFAP1.1 和 tmFAP1.2 表现最出色。
tmFAP1.1 在膜环境下能稳定表达,并与 HBC 分子结合,初步 Kd ~ 230 nM;
tmFAP1.2 通过进一步优化,亲和力提升到 18 nM,量子产率高达 0.84,几乎与天然 RNA aptamer Pepper 持平;
更重要的是,tmFAP 对目标分子 HBC599 表现出高度特异性,几乎不与其他类似分子结合(Fig.2e–f)。
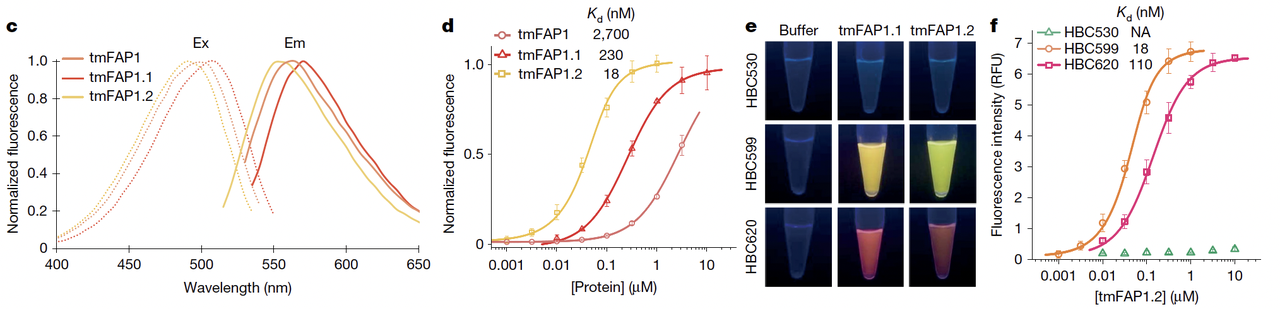
3.4 科学亮点
第一次 在跨膜蛋白中实现了非共价小分子识别,并且亲和力达到纳摩尔级;
跨膜口袋的设计不是“运气撞上”,而是通过深度学习幻觉精准生成,这标志着 AI 在跨膜蛋白设计中真正发挥了“创造力”;
tmFAP 的亮度和性能,已经不再是“概念验证”,而是完全有潜力应用于活细胞成像。
用一句话总结:这一部分是把金鱼变成了会在沙漠里游泳的“沙漠鱼”——它们真的能在跨膜环境里稳定存在,还能点亮荧光。
4. 结构验证:设计与现实高度吻合
在蛋白质设计领域,最常见的质疑是:设计出来的模型和现实中折叠的蛋白,真的一样吗?
很多时候,计算机模型看似完美,但一到实验就“翻车”。
卢老师团队的厉害之处在于,他们不仅让 wFAP 和 tmFAP 在功能上表现优异,还通过高分辨率结构学手段证明:设计与现实几乎一模一样。
4.1 wFAP 的晶体结构:模型与现实重叠
在 Fig.3a–d 中,作者展示了 wFAP1.1 的晶体结构(分辨率 2.3 Å,空口袋)和与 HBC599 结合后的结构(分辨率 2.1 Å)。
结果令人惊讶:
口袋的 Cα RMSD 仅 0.4–0.6 Å,几乎和设计模型重合;
HBC599 分子紧紧嵌在口袋里,与预测的结合方式完全一致;
关键氨基酸(如 D51、D26)和 HBC 的相互作用,在实验结构中被清晰捕捉到。
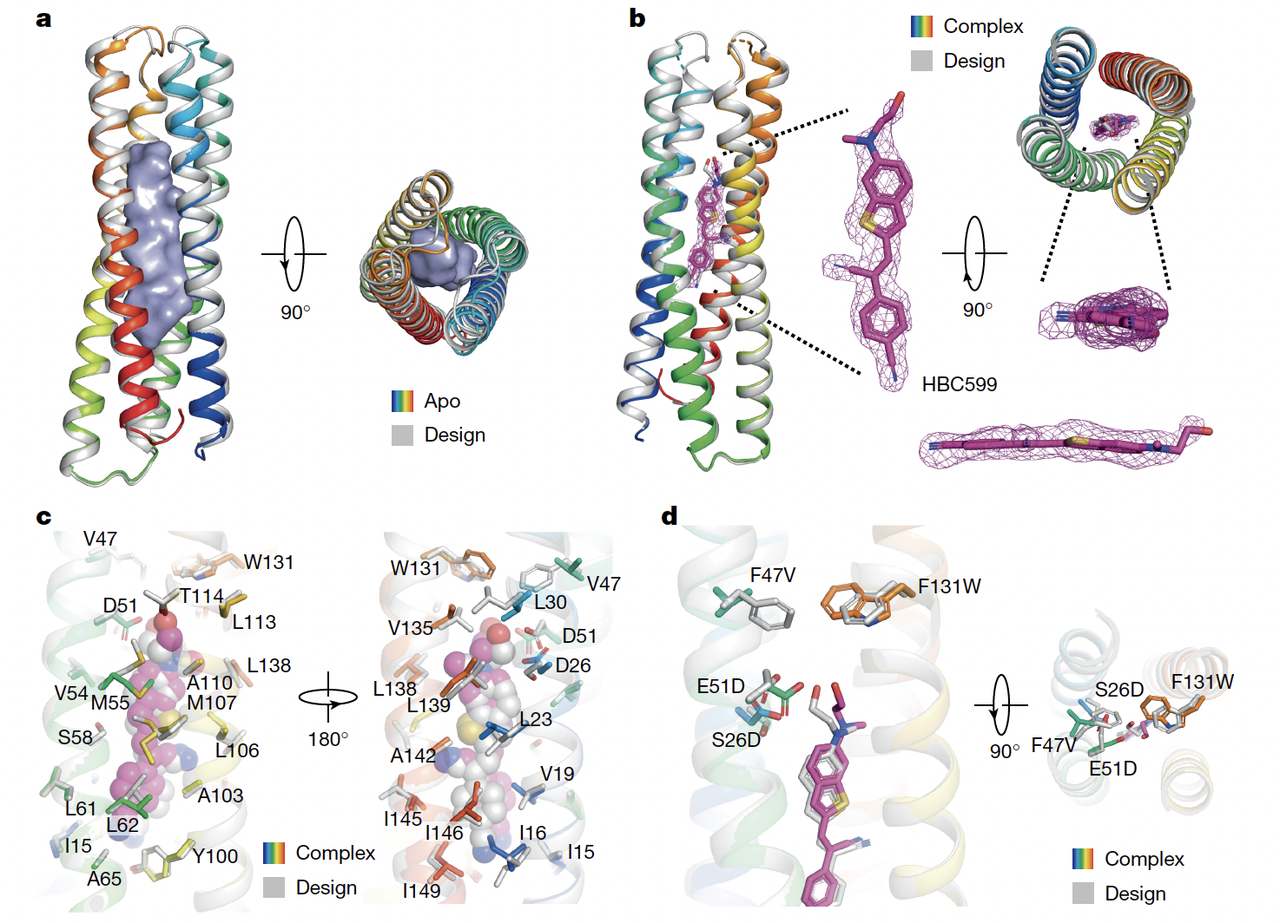
这意味着:wFAP 的口袋并不是实验偶然形成,而是设计驱动下的稳定构象。
4.2 tmFAP 的 cryo-EM 结构:小蛋白的“硬核考验”
跨膜蛋白更难解析,尤其是这种只有四根螺旋的小蛋白。
作者采用了巧妙的“BRIL 融合 + Fab”策略,把 tmFAP1.1 稳定化后进行冷冻电镜解析(Fig.4a–c)。
结果依旧惊艳:
分辨率 2.79 Å,四螺旋束完整呈现;
HBC599 的密度清晰可见,被完全包裹在螺旋核心中;
口袋残基的位置与设计模型高度吻合,RMSD 仅 0.74 Å。
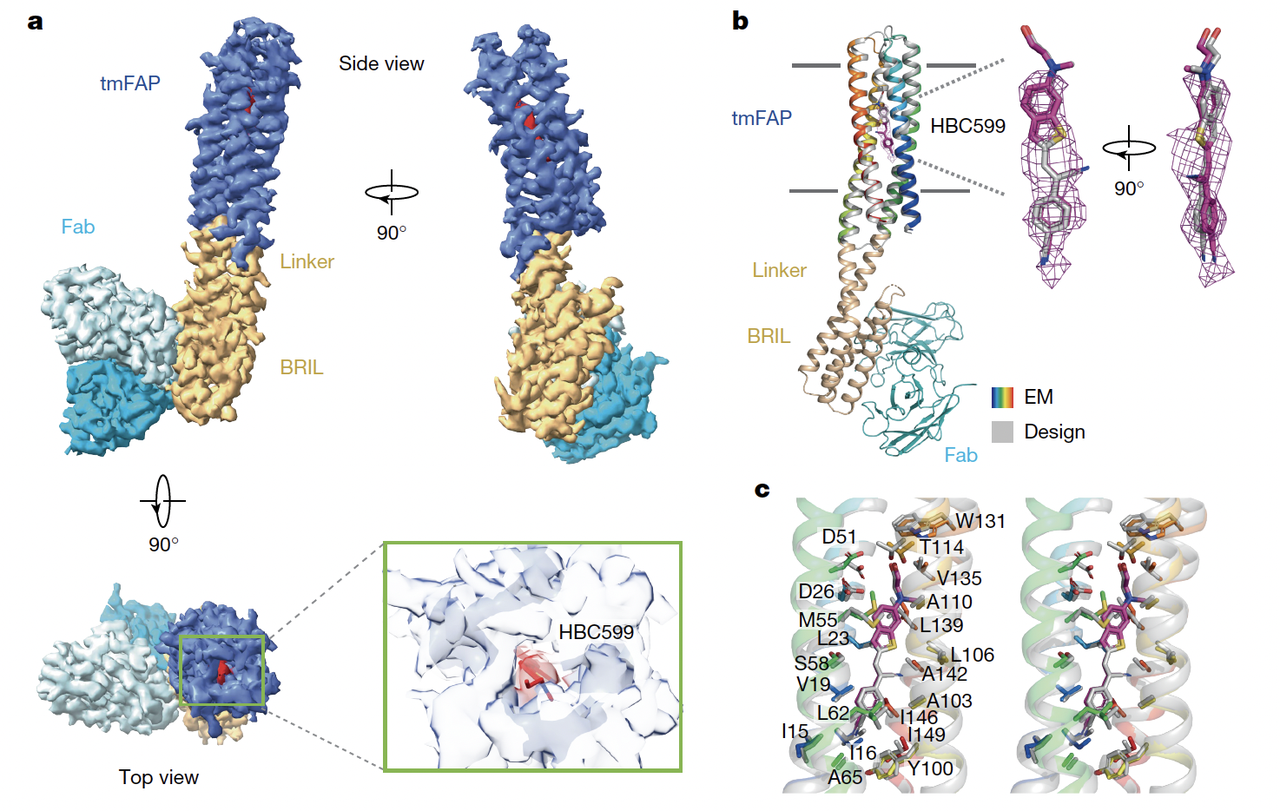
更有意思的是,作者还通过点突变实验进一步验证:
只要改动几个口袋关键残基(如 D26A、W131A),荧光信号就完全消失。
这和结构信息完全对应,再次说明设计口袋确实是“按图施工”的。
4.3 科学亮点
这是 de novo 蛋白设计少有的“全链闭环”:从计算模型 → 功能验证 → 高分辨率结构 → 与模型重叠;
结构学结果让这项工作从“好像有效”变成了“确实精确”,奠定了设计方法的可靠性;
尤其是 tmFAP 的 cryo-EM 成功解析,说明即使是人工设计的跨膜小蛋白,也能达到天然蛋白的结构稳定度。
一句话总结:结构验证这一步把文章从“功能演示”提升到“原子级精确”,是整个工作最硬的证据。
5. 在活细胞中的表现
蛋白设计如果只在纯化的体系里好用,其实价值有限。真正的考验是:能不能在活细胞中稳定表达,并且完成它的功能?
卢老师团队在这一点上同样给出了漂亮的答案。
5.1 wFAP:自由分布,甚至可定位线粒体
在 Fig.5a–b 中,作者展示了大肠杆菌和 CHO 细胞的成像结果:
在细胞质中表达的 wFAP1.1,遇到 HBC599 分子后,全细胞均匀亮起红色荧光;
当 wFAP1.1 融合上线粒体定位信号(SYNJ2BP)时,荧光就清晰地只出现在线粒体位置。
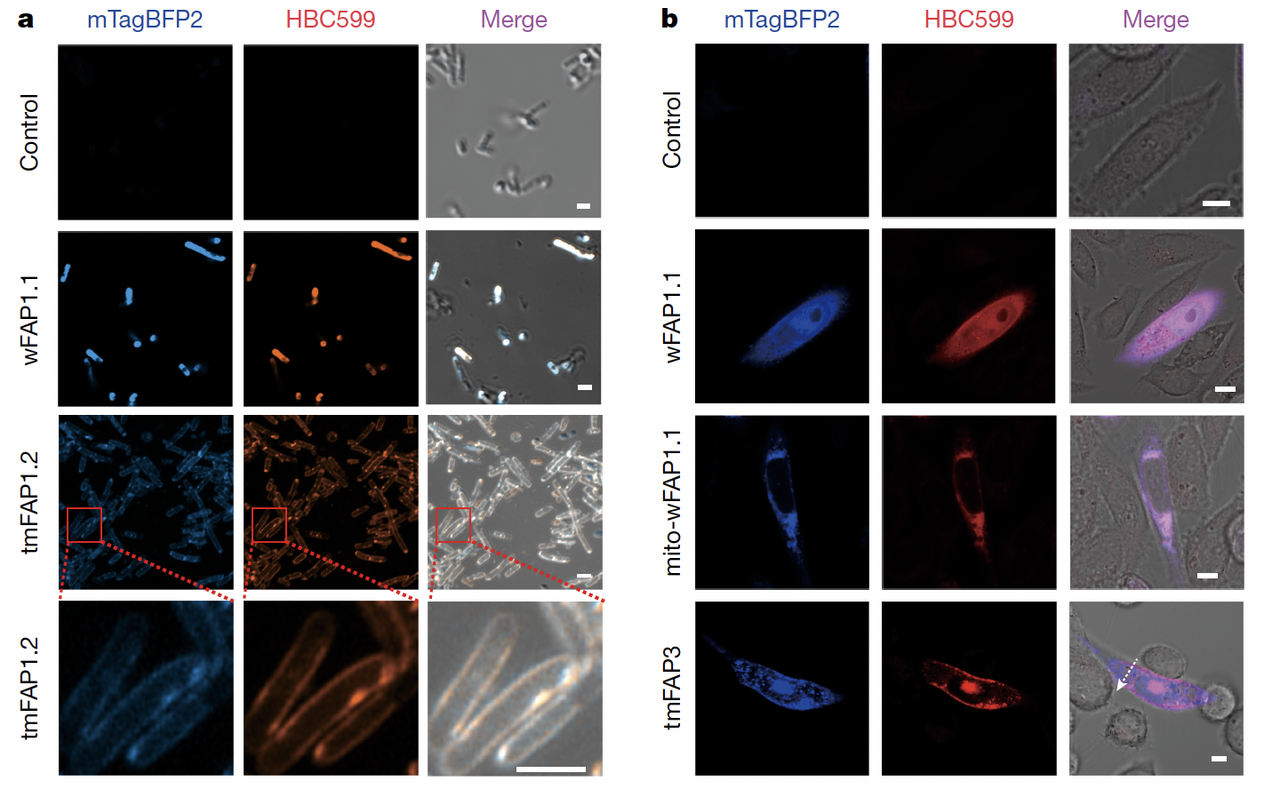
这说明:设计的蛋白不仅能点亮分子,还能作为“分子灯泡”被精准安放到细胞器。
5.2 tmFAP:镶嵌在膜上,点亮边界
相比之下,跨膜版本的 tmFAP1.2 和 tmFAP3,则在细胞膜或内膜系统中“点亮边界”。
在大肠杆菌中,tmFAP1.2 的荧光信号清晰地环绕在细胞周边,而细胞质是暗的;
在哺乳动物 CHO 细胞中,tmFAP1.1 分布于内膜系统,而 tmFAP3 经过进一步优化后,可以定位到质膜,并在膜上产生明亮荧光(Fig.5c)。
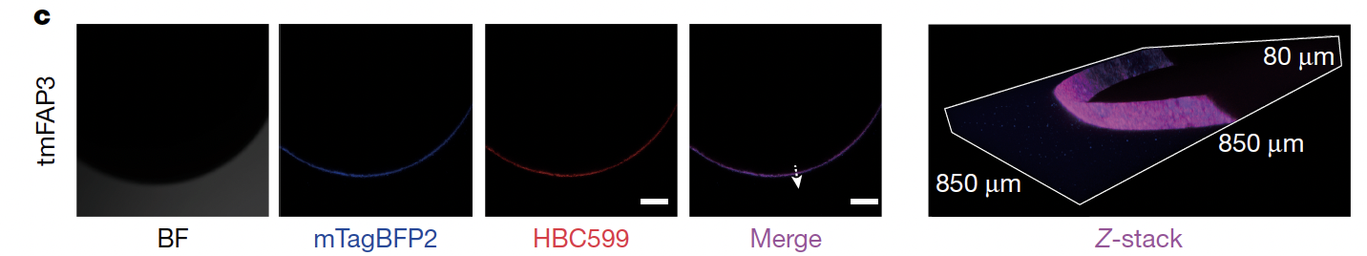
更酷的是,在非哺乳动物的 Xenopus 卵母细胞里,tmFAP3 同样能成功镶嵌到质膜,并点亮大面积的荧光区域。这说明它的适用性不受细胞种类限制。
5.3 科学亮点
wFAP 和 tmFAP 在活细胞中的荧光信号强烈、背景极低,说明设计具有高度特异性;
跨膜版本的 tmFAP 可以直接作为膜标记工具,甚至为未来的电生理和膜动力学研究打开了可能性;
设计蛋白能够在不同细胞环境中正确折叠、定位和工作,这一点极大提升了它们作为“通用工具”的潜力。
这些设计出来的蛋白,不是实验室里的“摆设”,而是能在真正的生命系统中工作、发光的工具
6. 结论与展望
这项工作最震撼的地方在于:它不仅证明了“跨膜蛋白–小分子非共价结合”是可设计的,而且做得比天然体系更好。
6.1 和天然荧光膜蛋白的对比
在 Fig.6 中,作者把他们设计的 tmFAP 和经典的天然膜蛋白 archaerhodopsin-3 放在一起比较:
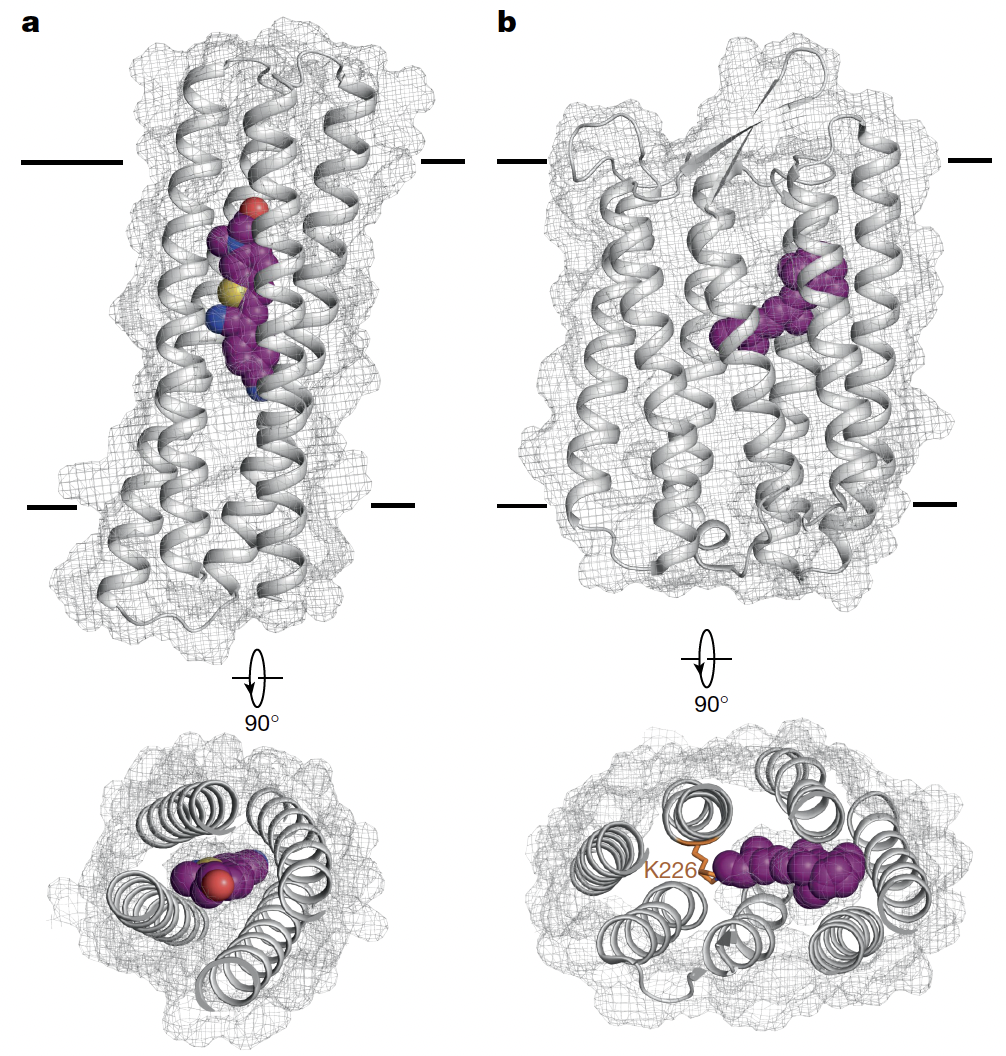
体积更小:tmFAP 只有四根跨膜螺旋,而 rhodopsin 有七根;
结合方式不同:tmFAP 与 HBC599 是非共价结合,灵活可替换;而 rhodopsin 必须依赖共价固定的视黄醛分子;
亮度更高:tmFAP1.2 的亮度几乎比 archaerhodopsin-3 高出一千倍,甚至超过了迄今最亮的天然 rhodopsin(NeoR)。
这意味着:设计出的蛋白已经不是“模仿自然”,而是超越自然。
6.2 应用前景
成像工具:tmFAP 可以作为新一代膜定位探针,结合不同的人工荧光分子,扩展成多色工具箱;
传感器开发:通过替换荧光分子或优化口袋,可以设计成 pH、膜电位甚至代谢物的传感器;
分子机器的基石:这类高精度的跨膜口袋,未来可能被拓展为人工受体、转运体或离子通道。
更进一步,tmFAP 的结合是非共价的,这意味着染料在光漂白后可以被溶液中的新分子替换,从而实现长时间成像不中断——这是天然荧光蛋白难以企及的优势。
6.3 总结
从 水溶性设计 → 跨膜化 → 结构验证 → 细胞应用 → 对比天然体系,卢培龙团队展示了一条完整的、可复制的“设计路线”。
这不仅是一次 de novo 蛋白设计的突破,更像是在为未来的“人工膜蛋白学”奠基。
他们让我们看到了一个未来——跨膜蛋白不再是自然的恩赐,而是人类可以自由设计、定制和超越的分子机器。
延伸阅读
本文属于 AI4S文献 栏目。
返回 AI4S文献 → 去公众号阅读完整版 →