Cell|de novo 设计多肽,实现对病态钠通道的特异性调控
蓝极说:
今天要分享的是 Cell 昨天(2025.08.19)刚刚online的一篇工作 —— 《De novo design of a peptide modulator to reverse sodium channel dysfunction linked to cardiac arrhythmias and epilepsy》。这篇文章报道了一个从零设计的多肽 ELIXIR,它能精准修复病态钠通道的功能异常,从而逆转心律失常和癫痫模型中的病理表型。
之所以选择讲这篇文章,有两个原因:
一方面,蛋白质设计在膜蛋白上的应用一直极少。相比可溶性蛋白,膜蛋白结构更复杂、动态性更强,给计算设计带来了巨大挑战。
另一方面,钠通道是膜蛋白里最“庞然大物”之一,不仅由四个重复结构域组成,还参与复杂的电生理调控。长期以来,即使是结构预测也常常不够准确,更别提基于结构的精准设计。
正是在这样的背景下,这篇工作首次展示了:我们可以用 de novo 蛋白质设计的方法,写出一条短肽,精准调节钠通道的病态功能。这不仅是一项技术突破,也为“通道病”治疗打开了新思路。
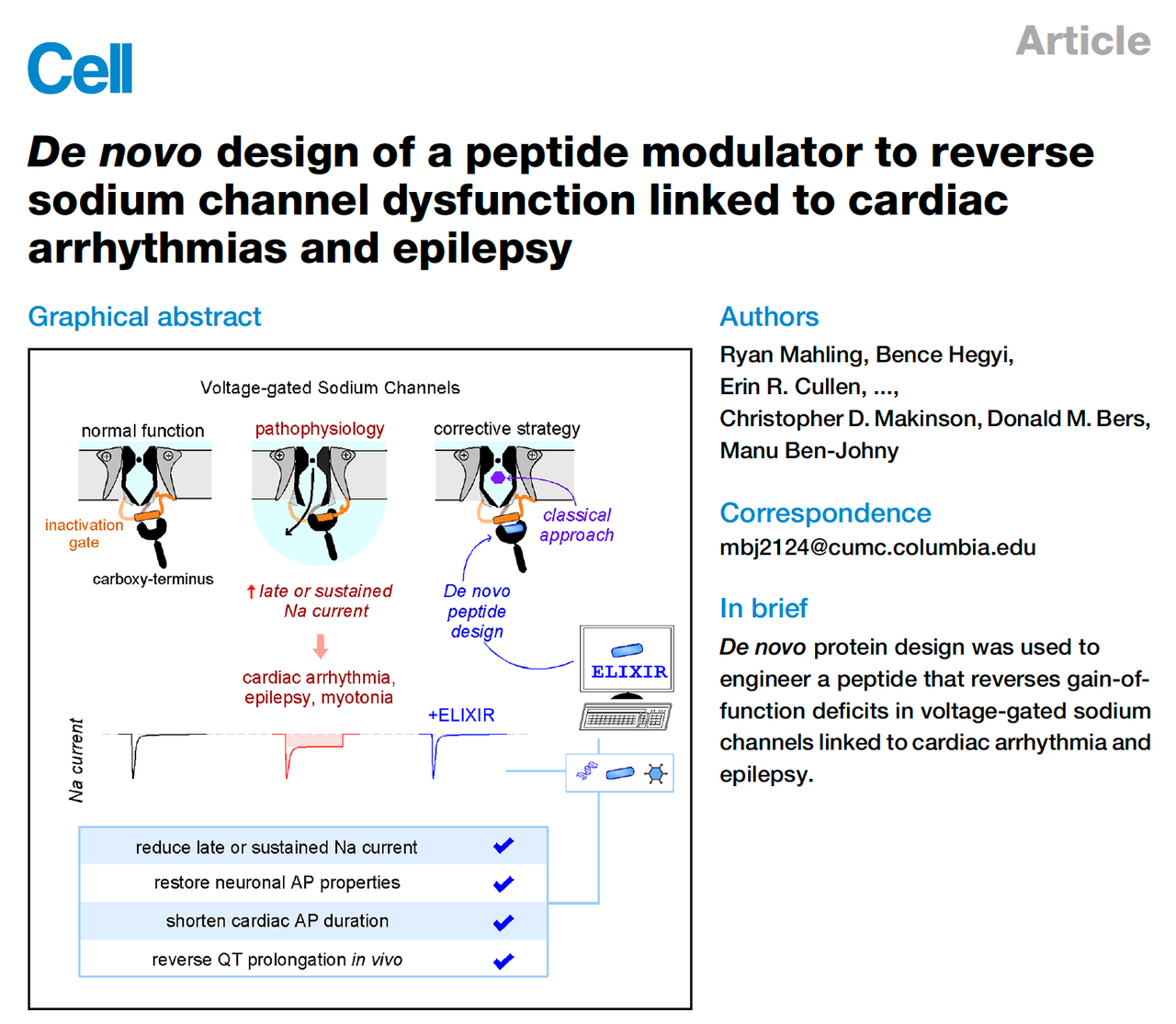
心脏跳动异常,或者神经元“放电过度”,往往会让我们想到 心律失常 和 癫痫 这两类严重疾病。它们看似不同,一个是心脏病,一个是神经系统疾病,但在分子层面却有着惊人的共性——电压门控钠通道的“失控”。
正常情况下,钠通道打开后很快关闭,动作电位能被严格调控;但一旦失活环节出了问题,就会出现一个不该存在的“尾巴电流”,也就是所谓的 晚钠电流(late sodium current, INaL)。这个持续的钠离子渗入,会拉长心脏动作电位,增加心律失常风险;在神经元中,它则导致过度兴奋,触发癫痫发作。
传统的小分子药物,比如 Ranolazine,虽然能一定程度上抑制晚电流,但往往“刀子太钝”,既切掉了病态信号,也容易误伤正常通道,甚至带来副作用。
就在这样的背景下,这篇 Cell 的新工作登场了:研究团队用 蛋白质设计,从零开始创造了一条全新的小肽——ELIXIR。它的使命不是“无差别打击”,而是精准修复:只锁定那些病态的钠通道,把它们拉回正常轨道。
1. 机制与设计思路:如何用蛋白质设计修复钠通道?
1.1 病变的起点:晚钠电流
要理解 ELIXIR 的设计逻辑,我们先要看看病变通道的问题出在哪。
在正常情况下,钠通道会快速激活和失活,让动作电位“一闪即逝”。但在一些心律失常和癫痫相关突变中,失活环节出现障碍,导致通道持续漏钠,产生 晚电流(INaL)。这种不该存在的电流让心肌动作电位延长(心律失常风险↑),或让神经元过度兴奋(癫痫风险↑)。
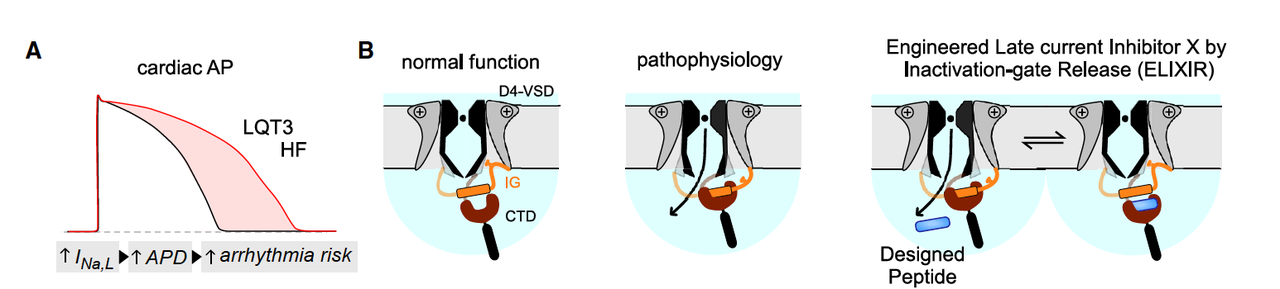
1.2 关键弱点:失活门与 CTD 的“卡位”
钠通道的失活依赖一个“失活门”(inactivation gate, IG),它像插销一样能迅速把通道堵上。
正常情况下:IG 会从 CTD 的 EF-hand-like 区域(EFL)释放,再去孔口完成“关门”。
病理情况下:IG 被卡在 EFL 上,没法去执行任务 → 通道持续漏钠。
这意味着,EFL 是一个理想靶点:如果有东西能和 IG 竞争性结合,就能把 IG“解救”出来,让它回到孔口,恢复正常失活。
1.3 设计策略:写一条“解锁肽”
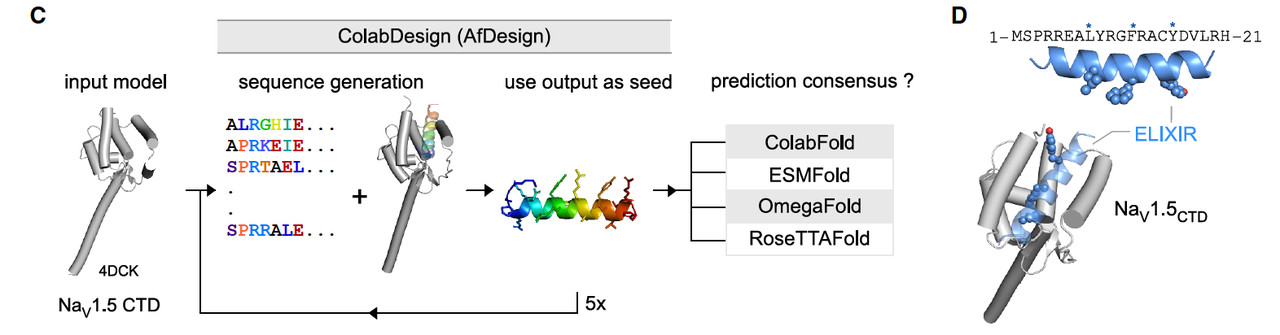
研究团队用 ColabDesign 进行了 de novo 设计,结果得出了一条 21个氨基酸的短肽,命名为 ELIXIR。它的设计考虑了几个关键点:
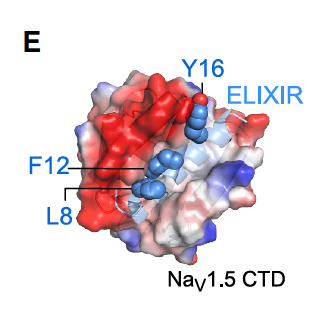
模仿失活门的关键特征
疏水性核心(L8、F12、Y16),刚好能嵌进 EFL 的疏水口袋。
两侧配上带正电残基,提高结合稳定性。
避免“抄作业”
与原生失活门的序列相似度只有 ~24%,说明这是一次“重新编写”,而不是简单复制。
在数据库里,它和已知蛋白都没有明显同源关系,是真正的 de novo 设计。
实验友好化改造
- 在第15位做了一个保守替换(C → S),避免体外实验中出现二硫键干扰。
1.4 功能关键残基验证
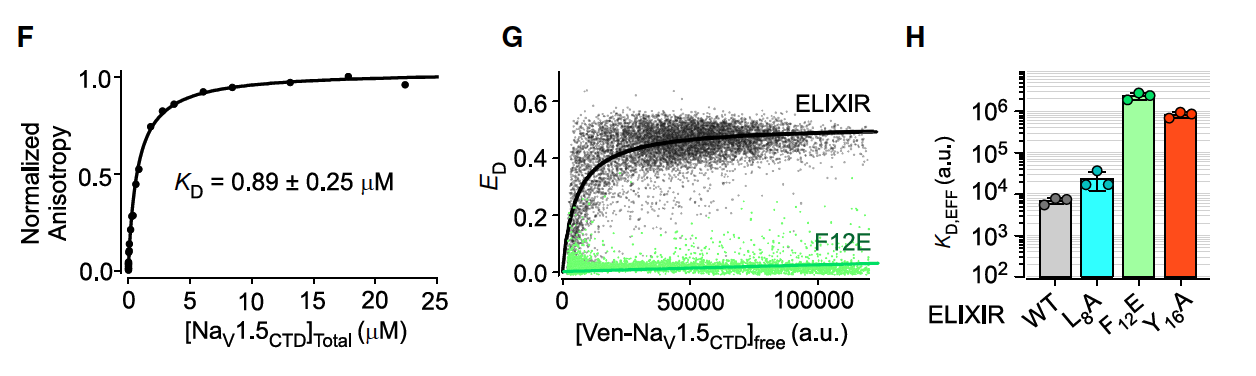
研究团队进一步用突变实验来证明设计的合理性:
把 L8/Y16 改成 Ala,F12 改成 Glu → 结合力和功能抑制效果显著下降。
说明这三个残基就是设计的“卡位核心”。
结合实验(荧光标记、FRET)也证实了 ELIXIR 与 NaV1.5 CTD 的结合亲和力在 亚微摩尔级别(KD≈0.9 μM)。
这说明,ELIXIR 并不是一条随意拼出来的肽,而是一个 基于结构逻辑、关键残基驱动的精准设计。
小结亮点:
ELIXIR 的设计逻辑是:
找准 EFL 这个卡位点,
写一条能塞进去的小肽,模仿但不复制失活门,
用关键残基保证结合和功能,
再通过实验逐步验证。
它就像一把特制的钥匙,精准插入钠通道调控区,把失活机制重新“解锁”。
2. 功能验证:精准抑制病态通道,而不伤正常功能
设计出 ELIXIR 之后,研究团队的第一个问题就是:它真的能在细胞里修复病态通道吗?
2.1 正常通道:几乎不受影响
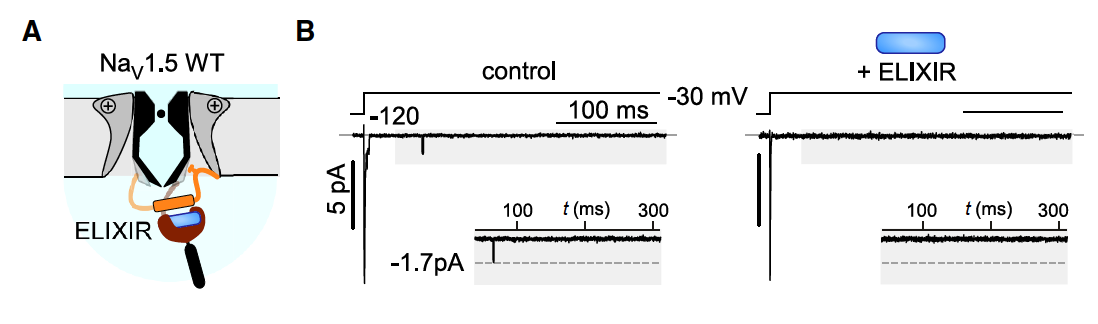
研究者在 HEK293 细胞中表达了 野生型 NaV1.5 通道,观察其晚电流 INaL。
正常情况下,INaL 本来就很低。
加入 ELIXIR 后,通道的激活、失活动力学几乎没有变化。
这说明 ELIXIR 不会乱动正常通道,选择性非常好。
2.2 病态突变体:显著修复
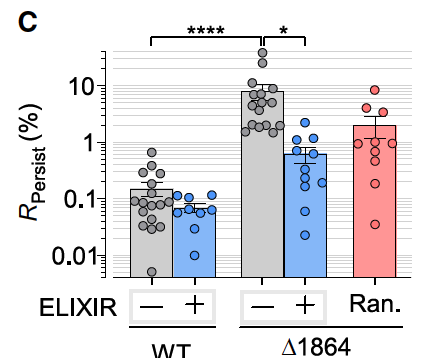
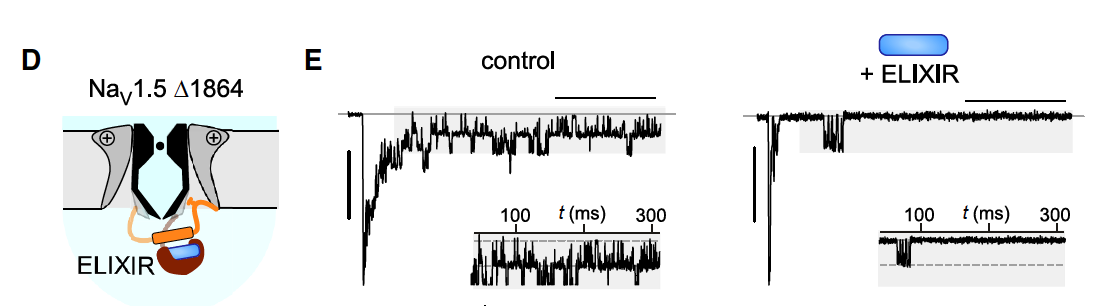
接下来,他们测试了一个与心律失常相关的 NaV1.5 Δ1864 突变体,这个突变会导致通道 CTD 缺失,晚电流暴涨(高达野生型的 ~40 倍)。
在这个病态背景下,ELIXIR 能让 INaL 下降超过 12 倍,几乎恢复到接近正常水平。
作为对照,临床常用的 Ranolazine(10 μM) 只能降低约 4 倍。
对比之下,ELIXIR 的选择性和效力远超传统药物。
2.3 功能-结构验证:关键残基决定效果
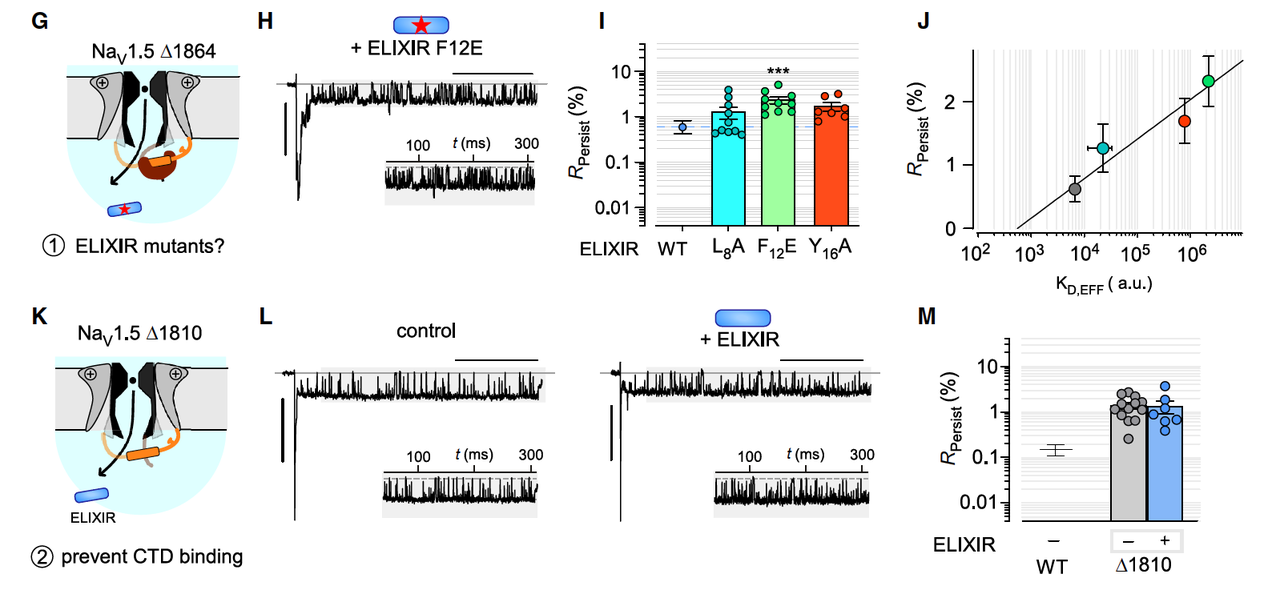
为了确认 ELIXIR 的作用真的依赖于它和 CTD 的结合,研究者做了几个关键实验:
把 ELIXIR 的 L8/Y16 改成 Ala,或者 F12 改成 Glu → 抑制效果明显下降。
把通道本身的 EFL 片段删掉(Δ1810 突变体) → ELIXIR 完全失效。
而且,结合实验的亲和力(KD)和功能抑制程度(INaL下降幅度)呈线性相关。
这直接证明了:ELIXIR 的抑制效果 依赖于它精准结合在 NaV1.5 的 CTD-EFL 位点。
这一部分的亮点总结:
精准性:对野生型几乎无影响,但能强效抑制病态突变体。
优效性:效果优于传统小分子药物 Ranolazine。
机制验证:作用完全依赖设计的结合位点,实验数据和设计逻辑高度吻合。
换句话说,ELIXIR 并不是“一刀切”的钠通道抑制剂,而是一种 “病理选择性修复因子”。
3. 广谱效应:跨突变、跨机制、跨亚型的修复能力
3.1 多突变、多机制下的通用性
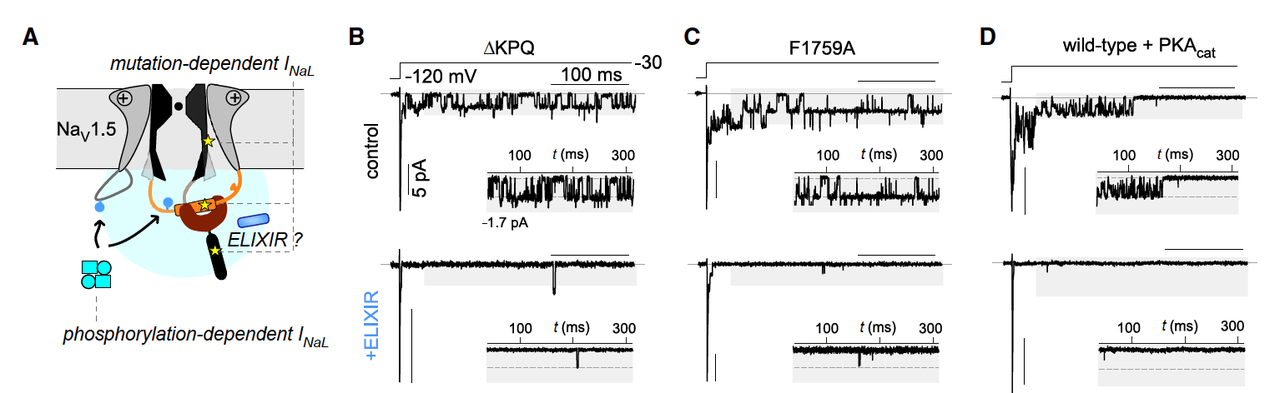
钠通道病变并不仅仅是一个突变,而是可以通过不同机制导致晚电流升高:
经典 LQT3 ΔKPQ 突变 → ELIXIR 抑制晚电流约 13 倍。
药物耐受性突变 F1759A(对传统抗心律失常药无效) → ELIXIR 依然能抑制 ~12 倍。
IQ/AA 突变(阻断 CaM 结合) → ELIXIR 也能显著降低晚电流。
激酶修饰导致的病理状态:
PKA 过度活化 → 晚电流 ↑5 倍,ELIXIR 可逆转。
CaMKII 突变活化 → 晚电流 ↑2 倍,ELIXIR 也能修复。
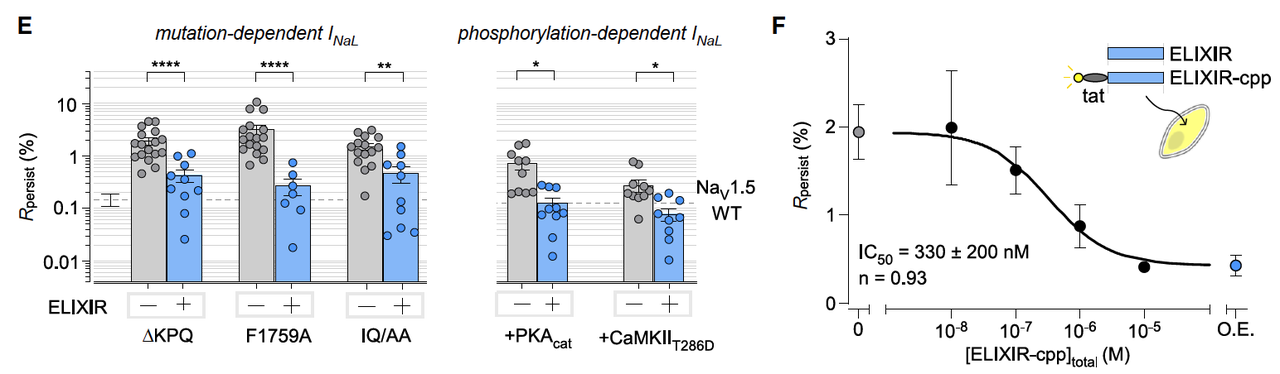
无论是基因突变还是后天修饰,只要机制导致失活受阻,ELIXIR 都能“接管修复”。
3.2 剂量依赖性
为了让 ELIXIR 能进入细胞,研究团队给它加了一个细胞穿透肽(cpp),命名为 ELIXIR-cpp。
结果显示 ELIXIR-cpp 在细胞内呈剂量依赖性抑制晚电流,IC50 ~ 330 nM。
这一数值与它在体外测得的结合亲和力(~0.9 μM)高度一致。
说明它的作用并非偶然,而是一个可控的剂量效应。
3.3 跨亚型的病理选择性
人体有 9 种不同的 NaV 通道亚型(1.1–1.9),分布在心脏、神经、肌肉等不同组织。一个潜在风险是:ELIXIR 会不会误伤其他亚型?
野生型 Nav1.1、Nav1.4、Nav1.6、Nav1.7:ELIXIR 几乎没有影响。
病理突变型:
Nav1.4 F1698I(肌强直相关突变) → 晚电流升高 ~4 倍,ELIXIR 可完全拉回到正常水平。
Nav1.6 N1768D(癫痫突变) → 晚电流升高 ~10 倍,ELIXIR 也能逆转接近正常。
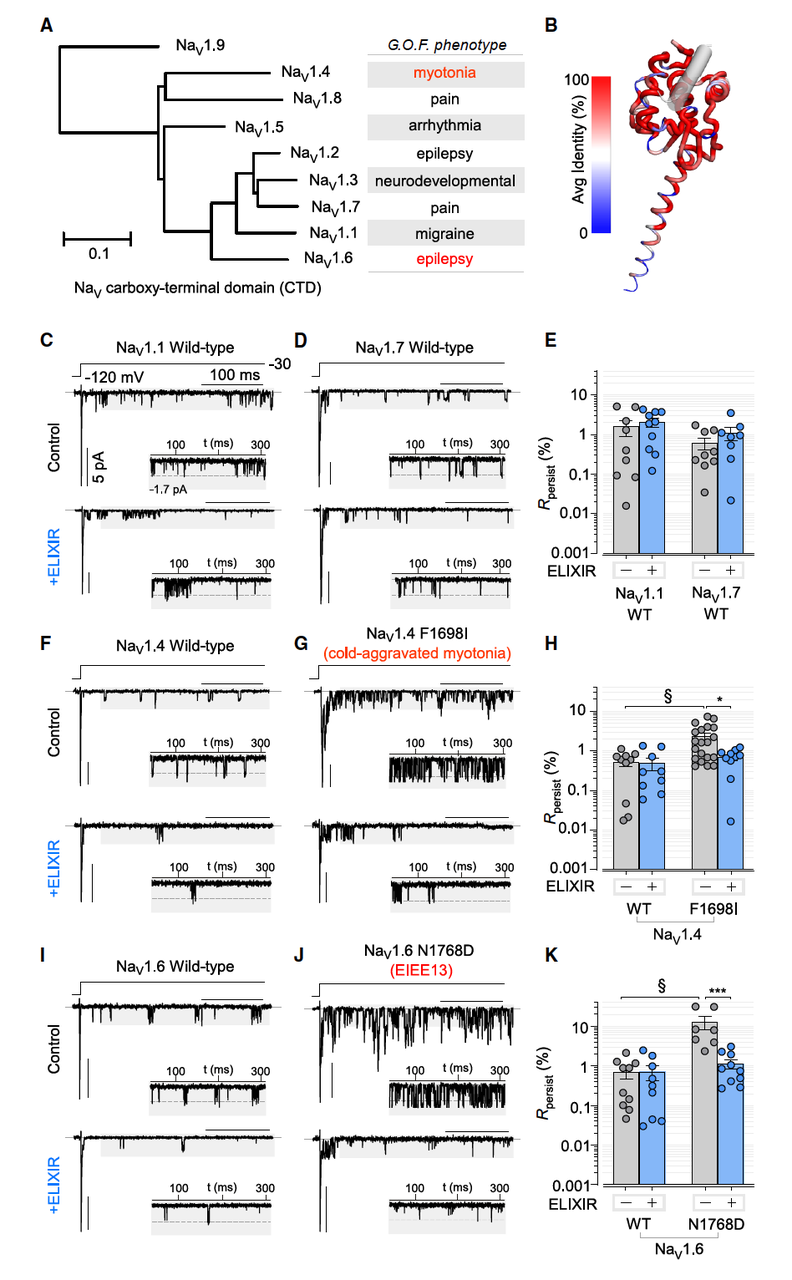
也就是说,ELIXIR 只在通道“病态失活”的情况下发挥作用,野生型则几乎不受影响。
这一部分的亮点总结:
广谱有效:无论是不同突变(ΔKPQ、F1759A、IQ/AA)还是不同机制(PKA、CaMKII),ELIXIR 都能抑制晚电流。
剂量可控:表现出经典的剂量依赖性。
病理选择性:对正常通道无影响,但能精准修复病态亚型(心脏、神经、骨骼肌均验证)。
这使 ELIXIR 不只是“单一病的工具”,而是潜在的 “跨疾病通道修复平台”。
4. 从动物到患者:跨层级的功能验证
4.1 癫痫小鼠的神经元修复
研究团队在一个 SCN8A N1768D 突变小鼠模型 中测试了 ELIXIR。这类小鼠表现为:
神经元动作电位(AP)延长,
频繁出现 去极化阻滞(depolarization block),导致神经元无法正常发放,
临床上对应严重癫痫和 SUDEP(癫痫猝死)。
他们用 AAV9 病毒把 ELIXIR 基因送入小鼠脑内:
结果:突变神经元的动作电位时程(APD)缩短,接近正常水平。
去极化阻滞明显减少,神经元放电恢复规律。
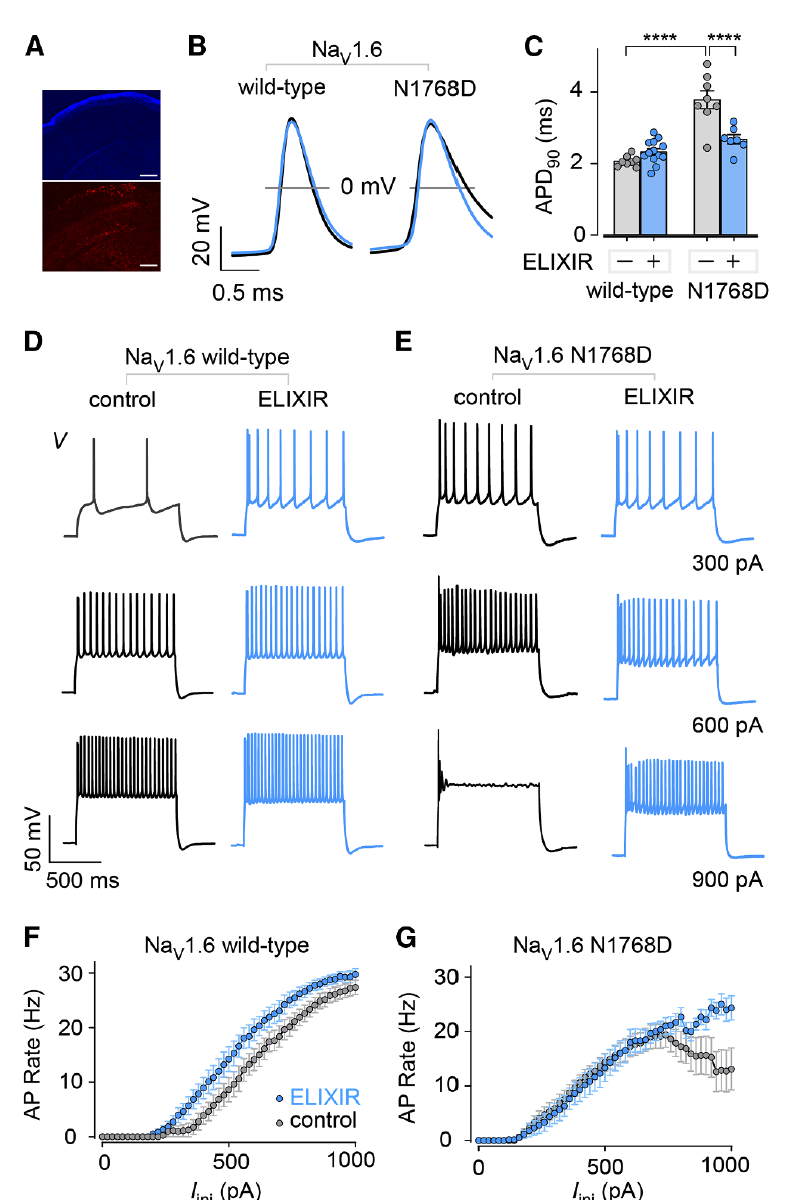
ELIXIR 在神经系统中 不仅抑制晚电流,还能实实在在修复神经元的电生理功能。
4.2 心衰小鼠的心肌细胞修复
在心脏病模型中,研究者选择了 CaMKIIδ 过表达小鼠,这种小鼠会发展为心力衰竭,心肌细胞的晚电流显著升高。
用 ELIXIR-cpp(带细胞穿透肽)处理心肌细胞后:
晚电流下降到接近正常水平,
动作电位时程(APD)缩短,
动作电位的短期变异性(STV)降低,电活动更稳定。
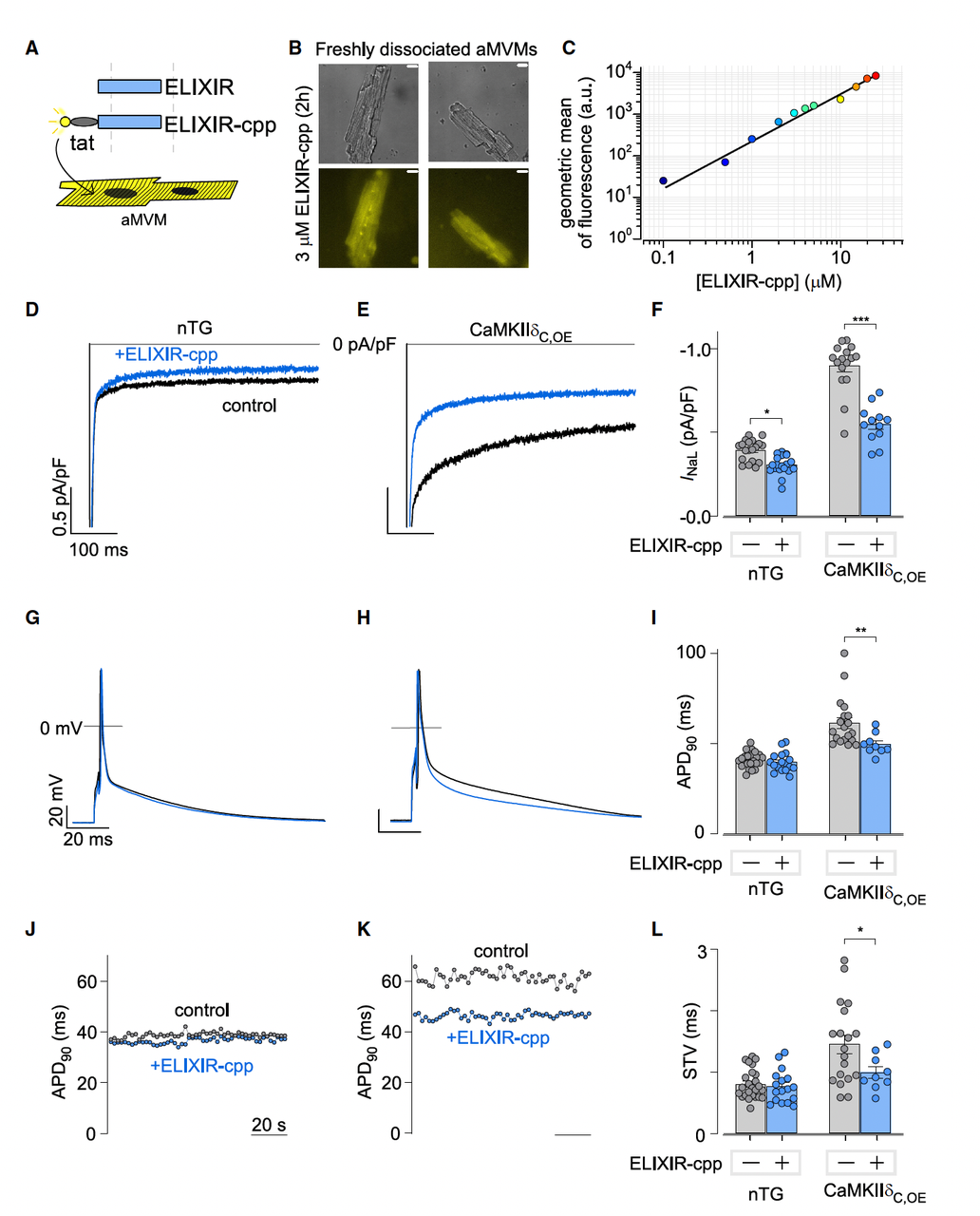
在心脏模型中,ELIXIR 展现出和神经模型类似的“病理修复”特性。
4.3 患者来源细胞 & 转基因小鼠验证
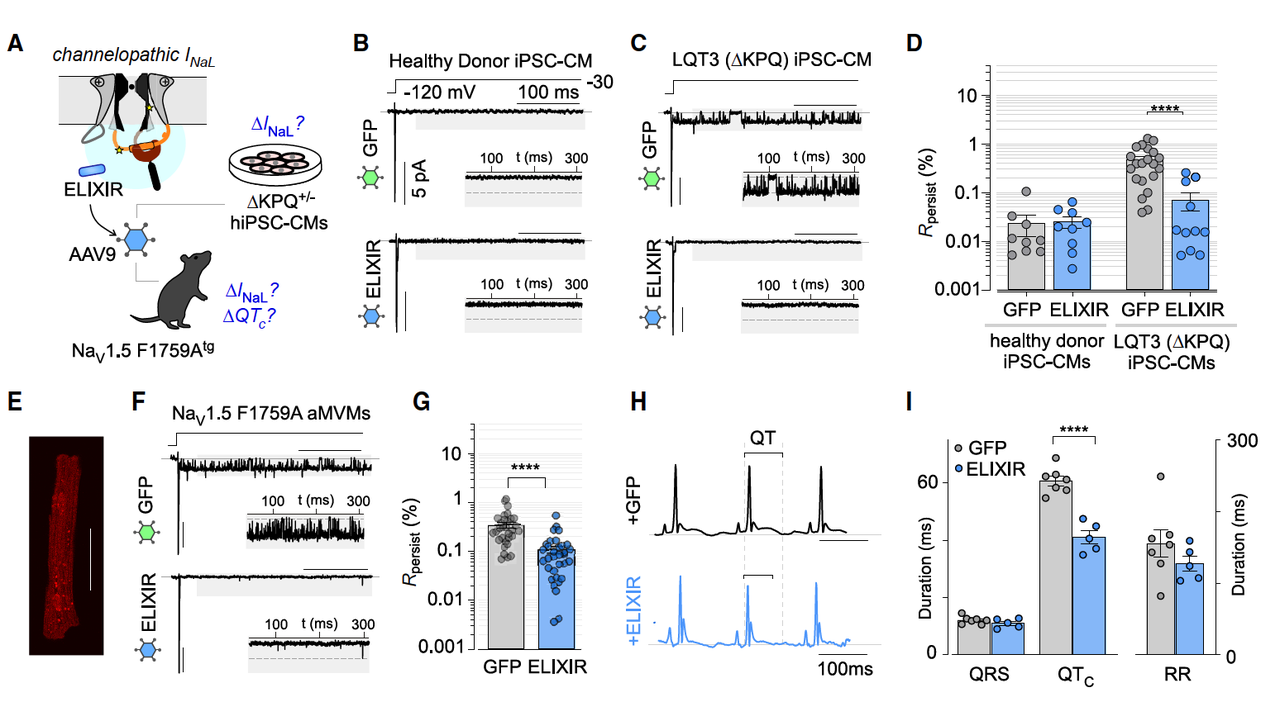
为了更接近临床,团队进一步测试了:
LQT3 患者来源的 iPSC 心肌细胞(ΔKPQ 突变):
突变细胞晚电流升高明显,
ELIXIR 表达后晚电流下降到接近健康供体水平。
F1759A 转基因小鼠(抗药性心律失常模型):
心肌细胞晚电流升高,QT 间期延长,
ELIXIR 病毒注射后 → 晚电流下降,QT 间期显著缩短,心电图接近正常。
这是一个 从细胞 → 动物 → 患者来源细胞 的完整验证链条,强烈支撑 ELIXIR 的转化潜力。
这一部分的亮点总结:
癫痫模型:修复神经元 AP,减少去极化阻滞。
心衰模型:缩短动作电位时程,减少电活动不稳定性。
患者来源细胞 & 抗药性小鼠:成功逆转 LQT3 的病理表型。
从神经到心脏,从小鼠到人源细胞,ELIXIR 的“跨系统修复能力”得到了全方位验证。
5. 总结与前景:从实验室到未来治疗
通过从零设计的 21 个氨基酸短肽 ELIXIR,这篇工作展示了一个令人振奋的事实:
我们不仅可以理解离子通道的病理机制,还可以 用计算蛋白设计“写”出一个修复分子,把病态通道拉回正轨。
5.1 ELIXIR 的三大亮点
de novo 设计
不依赖天然蛋白或同源片段,完全是从结构逻辑出发设计的新分子。
这说明“从零开始写药”的时代正在到来。
病理选择性
对正常通道几乎没有影响,
但能精准识别和修复各种病态突变或修饰导致的晚电流异常。
相比传统药物“杀敌一千,自损八百”,ELIXIR 的策略更接近“精准修复”。
跨疾病通用性
无论是心律失常、癫痫,还是肌强直等钠通道病,ELIXIR 都能发挥作用。
这一点极大扩展了它的应用前景,未来可能发展为 “通道病修复平台”。
5.2 未来展望
临床应用挑战:
因为针对的靶点在细胞内,所以如何高效、长期、安全地把 ELIXIR 送入细胞,是转化的关键难题。
文章中使用了细胞穿透肽和病毒载体,这些方法各有局限。
优化方向:
通过 亲和力成熟 或 突变特异性设计,可以让 ELIXIR 更高效、更精确。
也可能通过小分子模拟,找到能模仿 ELIXIR 功能的新药物。
更大图景:
钠通道只是第一步,
这种 结构驱动的 de novo 蛋白质设计策略 完全可以扩展到钙通道、钾通道,甚至其他复杂膜蛋白。
它代表了一种 “精准修复分子缺陷” 的新药开发范式。
一句话总结:
ELIXIR 不只是一个为心律失常和癫痫设计的小肽,它更像是一个“概念验证”:我们可以通过计算蛋白设计,为通道病量身打造修复工具,打开未来精准医学的新可能。
6. 蓝极点评:
钠离子通道一直是一个很难进行binder设计的靶点,多肽设计相较于大的binder设计也更困难,这篇文章把两件难做的事情结合在一起,通过找到了一个很巧妙的切入点(针对胞内的CTD小区域做设计),通过不太难的设计方法,得到了很好的结果。所以,现在的设计工具已经足够强大,与其追求更好的工具,不如追求对靶点更深的理解。
延伸阅读
本文属于 AI4S文献 栏目。
返回 AI4S文献 → 去公众号阅读完整版 →