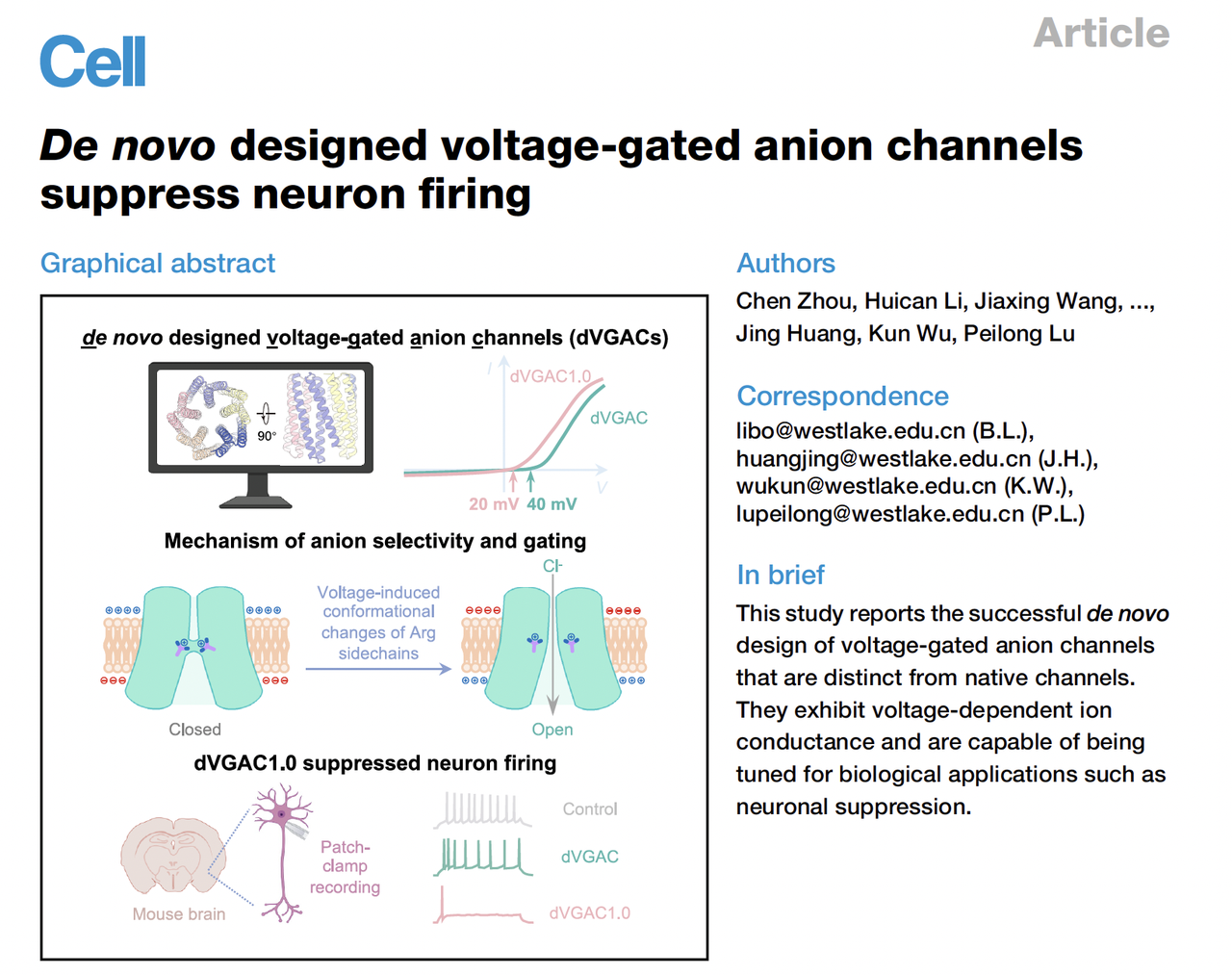
Cell|西湖大学卢培龙团队从头设计出可“感电”的人工离子通道
蓝极说:
在蛋白质设计的世界里,能稳定折叠的水溶性蛋白已经被攻克得七七八八;能镶嵌进膜的跨膜蛋白,也逐渐从“禁区”变成了“高地”;但要让一个人工蛋白“感受电压”、还能开关离子——这几乎是蛋白设计的“珠穆朗玛峰”。
今天,我们要聊的,是西湖大学卢培龙老师团队上周(2025.10.16)在 Cell 上发表的最新成果:
他们不仅从零构建出一个电压门控的阴离子通道(de novo Voltage-Gated Anion Channel, dVGAC),还让它真的在神经元里响应电压、抑制放电。
这是一个真正意义上的——
从结构到功能、从计算到电流、从“设计”到“感电”的里程碑。
🔗原文链接:https://doi.org/10.1016/j.cell.2025.09.017
一、从自然到设计:一个能“感电”的人工通道是如何诞生的
1. 研究背景:电压门控通道的“最后高地”
在生物电信号的世界里,电压门控离子通道(Voltage-Gated Ion Channels, VGICs) 是最核心的元件。它们嵌在细胞膜中,感受膜电位变化,从而调节离子流动,控制神经放电、心跳节律乃至肌肉收缩。
过去几十年,结构生物学已经揭示了VGIC的多种天然形式——从钾通道、钠通道到氯通道——但它们的“电压响应”几乎都依赖于庞大而复杂的结构域,例如典型的S1–S4电压感应区。这让“人工重建”变得几乎不可能。
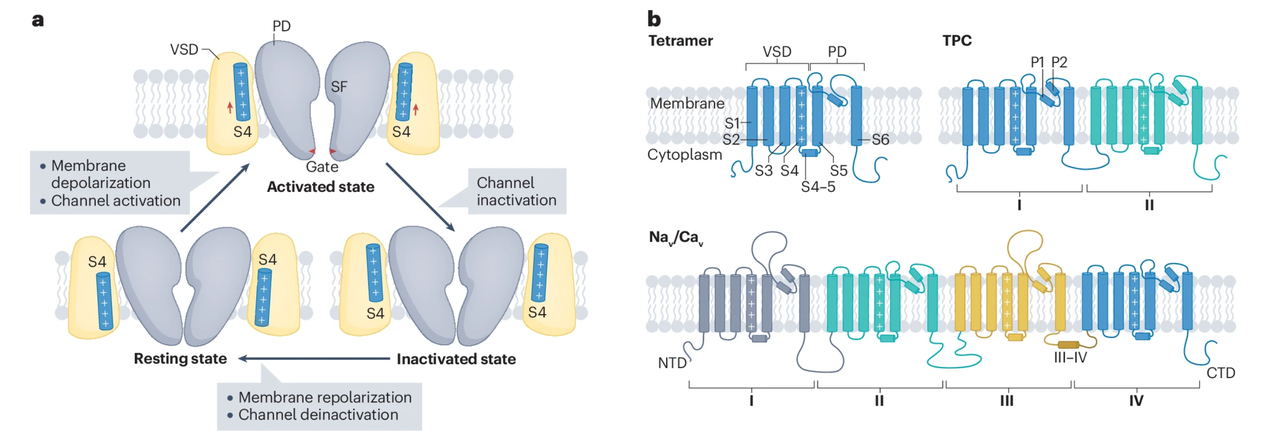
在蛋白质设计领域,研究者已经能构建出稳定的跨膜骨架、甚至可导电的“漏通道”,(卢老师之前也de novo设计出跨膜荧光激活蛋白,详情请查看:)但真正能被电压调控开关的人工通道,直到现在都未曾实现。
这正是卢培龙老师团队想要解决的问题:
能否从最基本的物理原理出发,设计出一个完全人工、可电压响应的离子通道?
2. 设计思路:从物理出发的极简门控模型
团队没有选择模仿天然通道的复杂结构,而是重新思考“门控”的最小物理单元。他们提出一种极简的电压响应假设:
如果一个跨膜通道在几何上对称、中心通透、且内部带有可移动的电荷,
那么它就有可能在膜电位变化时发生局部构象变化——实现电压门控。
为此,他们设计了一个五聚体三螺旋跨膜骨架(TMH3C5)。
每个亚基由三根跨膜α螺旋组成,五个亚基围成一个对称的中空孔道(Fig.1C–F)。外层螺旋稳定整个结构,内层螺旋形成导电通道。
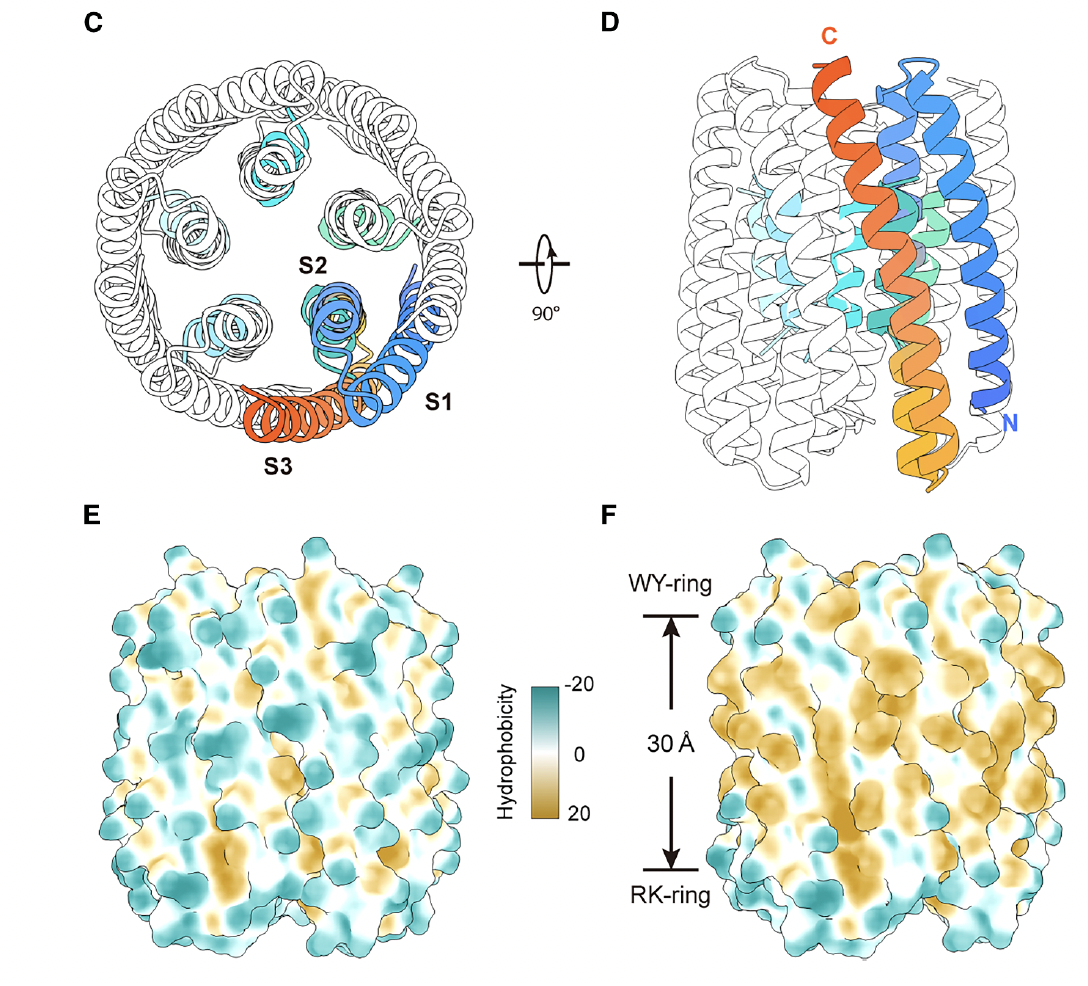
几何形态呈“漏斗状”:
宽的一端朝向胞内,窄的一端朝向胞外;
电场沿通道轴线方向作用于孔道中心——为电荷响应提供天然的物理环境。
这个设计不是模仿自然,而是从静电学与结构约束出发,为“感电”功能奠定了可计算、可操控的框架。
3. 关键设计:三层精氨酸构成的“电荷阀门”
骨架只是开始。要让通道“感电”,必须引入可响应电场的带电元件。
团队在孔道中心设计了三层带正电的精氨酸(Arg)环:
每层由五个亚基各提供一个Arg侧链,
三层沿通道轴线分布,形成连续的正电荷堆叠。
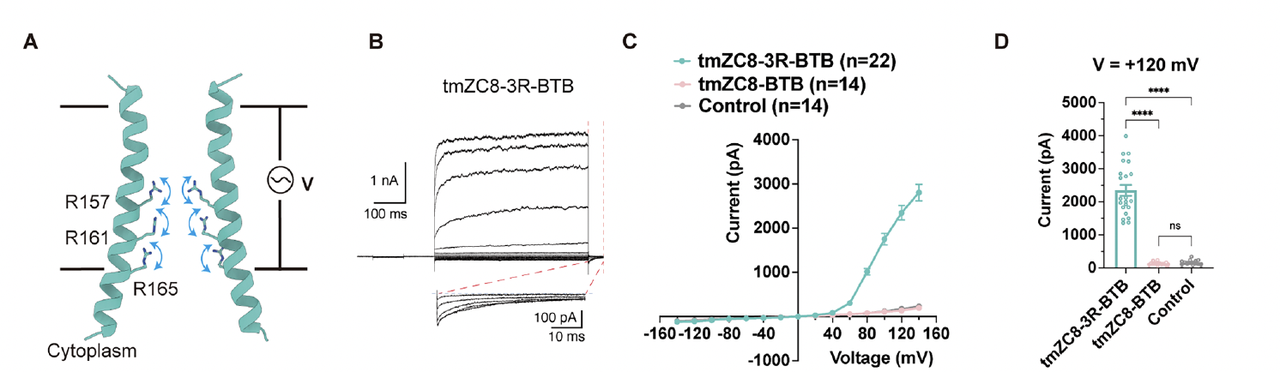
这种布局实现了两种功能的统一:
电压感应:电场变化会驱动Arg侧链在局部旋转与重排,
改变通道的孔径与电势能垒,从而调节离子通透;
阴离子选择性:带正电的孔道中心对Cl⁻具有天然吸引作用。
与天然通道的外部电压感应结构不同,这里是一个“内源式门控机制”:
门控单元直接位于导电孔中,由局部电荷分布实现电压响应。
这一设计简化了天然VGIC的复杂性,同时在原理上保持功能等价。
4. 电生理验证:从模型到电流
为了验证这一假设,研究团队在HEK293T细胞中表达不同设计版本的通道并进行膜片钳测试。
结果表明:
当通道中包含三层Arg电荷阀门时,出现显著的电压依赖性;
电流在正电位下迅速增强,负电位下几乎完全关闭,
呈现典型的外向整流(outward rectification)特征(Fig.2E–H)。
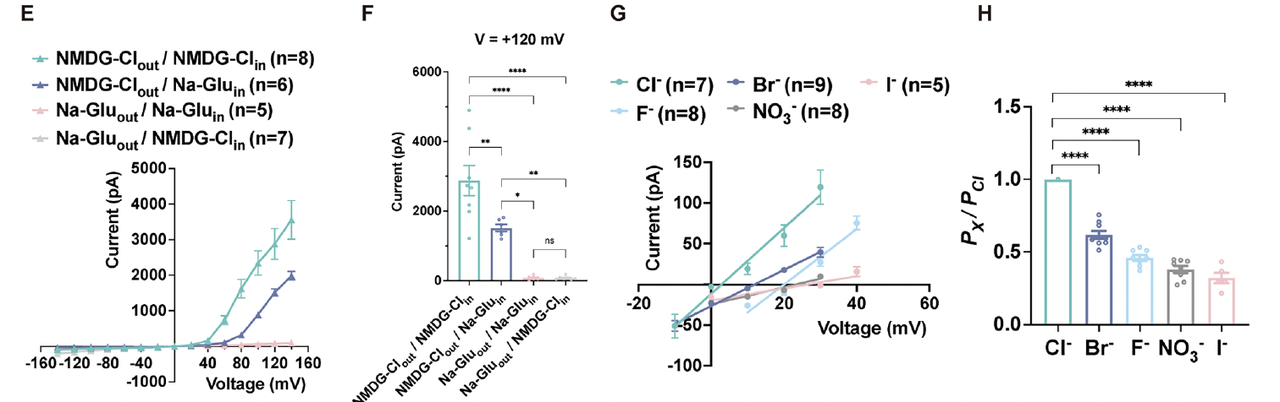
离子替换实验进一步证明该通道选择性导通Cl⁻离子;
单通道电导测定约为 42 pS(Fig.2I–K)。
实验结果说明,这个从零设计的蛋白不仅稳定折叠、嵌入膜中,还确实实现了电压门控的阴离子通透功能。
这使得它成为第一个具有可控电响应的de novo设计通道蛋白。
5. 小结:从结构到功能的物理闭环
这一部分构成了整篇工作的逻辑核心:
结构基础:对称且可预测的五聚体骨架;
电荷布局:精确分布的三层正电Arg环;
功能实现:实验验证的电压门控与离子选择性。
dVGAC 展示了一种全新的蛋白设计思路——
不依赖天然结构域,而是通过最小化设计,在人工骨架中实现复杂的生物功能。
这不仅是一次“能导电”的突破,更重要的是:
它证明了“电压感应”这一高度复杂的生物功能,可以被设计出来。
二、结构验证——Cryo-EM让“设计”变成“现实”
1. 从设计模型到原子级结构验证
在蛋白设计领域,一个常见的问题是:
“计算机里长得漂亮的模型,在现实中是否真的能折叠成那样?”
过去很多“成功的功能演示”最终都在结构验证中“翻车”,原因在于设计模型往往依赖理想化假设,而真实蛋白在膜环境中可能塌陷或错折。
卢培龙老师团队非常清楚这一点。
在功能验证之后,他们直接用冷冻电镜(Cryo-EM)解析了 dVGAC 的结构,分辨率高达 2.9 Å —— 这对于一个完全人工的跨膜小蛋白来说,这个分辨率已经非常高了。
2. 模型与结构的惊人重合
结果几乎完美:
Cryo-EM 结构与设计模型的主链均方根偏差(RMSD)仅约 1.1 Å,这意味着设计中每个原子的位置都被精确再现。
在结构图(Fig.3A–B)中可以看到:
五聚体的整体形态与计算模型高度一致,内外双层螺旋束排列清晰、对称中心未发生任何塌陷。
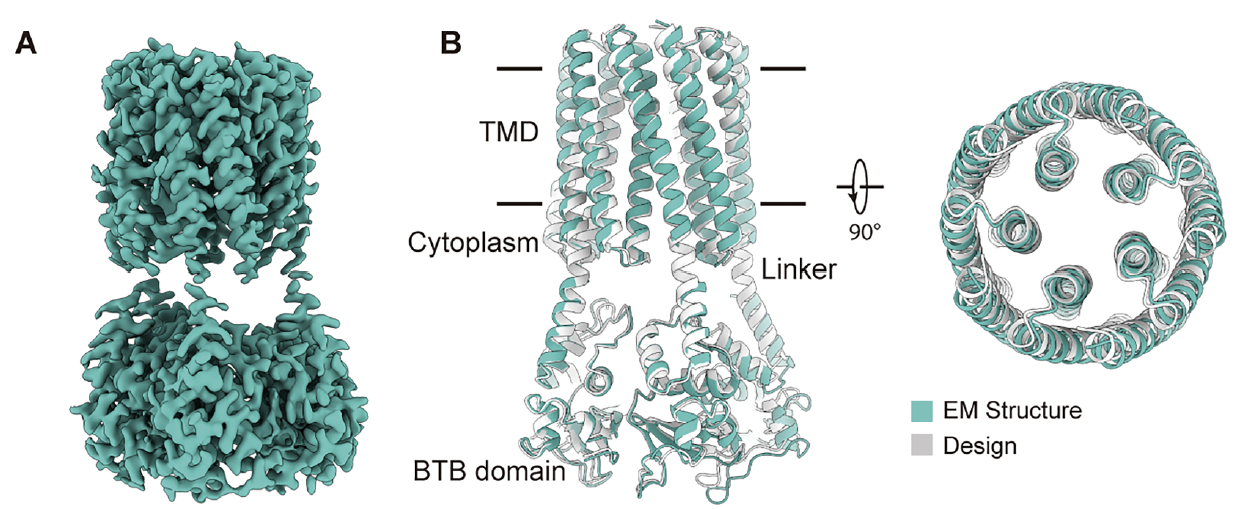
这一点极为关键——
它说明团队设计的跨膜几何与相互作用模式在膜环境中完全可实现,不再只是“计算的幻觉”。
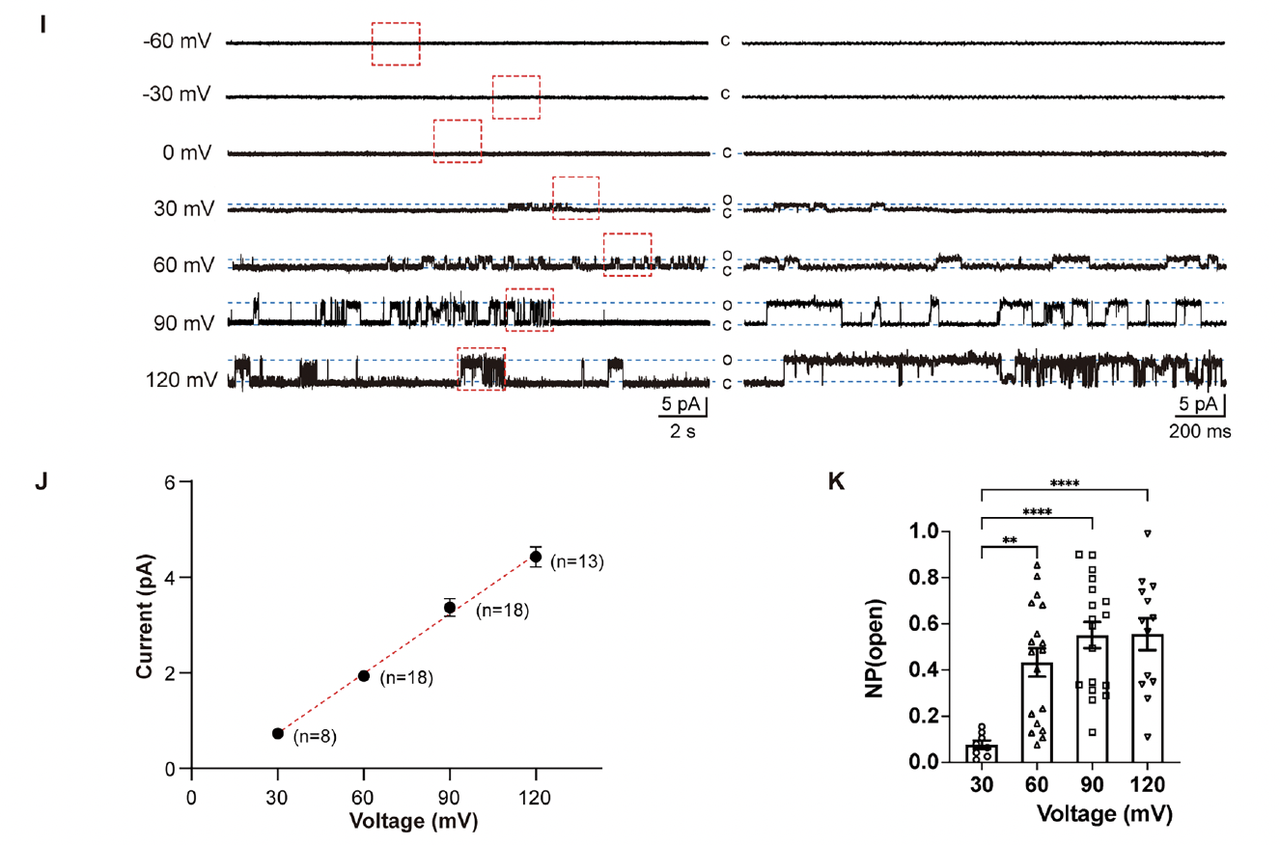
3. 电压门控的“微观开关”:R157的双构象
更令人兴奋的是,Cryo-EM 数据揭示了通道中心精氨酸层的构象双态性。
特别是位于中间层的 R157 残基,在同一结构中出现两种明显的取向(Fig3C-F):
一种指向通道轴心,形成收缩态;
另一种旋转外翻,形成开放态。
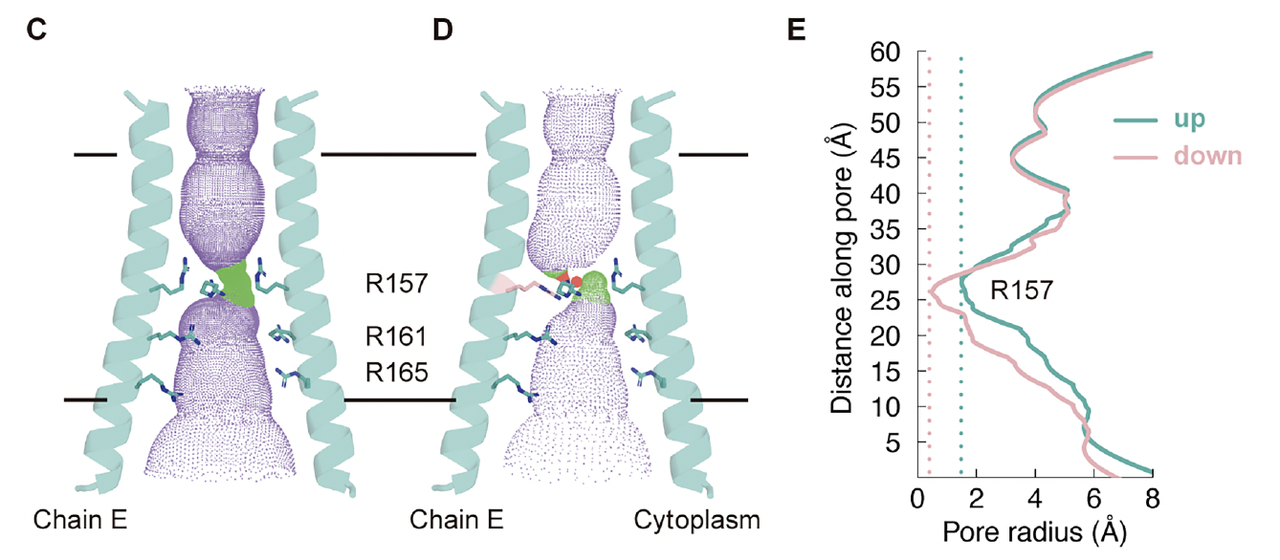
这与团队最初设想的“电压驱动下精氨酸侧链旋转”机制高度吻合。
也就是说,通道的开关状态并非依赖大尺度结构重排,而是由局部电荷侧链的旋转实现的。
在原子层面上,电压响应的“开门动作”被直接捕捉到了。
4. 离子识别的结构证据
为了进一步验证离子选择性,研究者在实验中加入了碘离子(I⁻),解析得到的结构中可以清晰看到:
位于底层的 R161 与 I⁻ 形成稳定的静电结合。
这一密度信号直接证明了通道对阴离子的亲和与特异性。
通道内部没有任何可见的阳离子结合位点,从结构上解释了其对 Cl⁻ 的高度选择性。
5. 结构验证的意义:从可计算到可制造
在这一步,研究团队实现了 de novo 设计的“闭环”:
计算模型 → 实验功能 → 原子结构对比 → 机制重现。
所有关键功能(电压响应、阴离子选择)都有结构证据支撑。
这不仅验证了 dVGAC 的设计正确性,
更说明这种“以物理机制为导向”的设计路径具备可预测性与可复制性。
三、机制剖析——“电荷层”如何让蛋白学会感电
1. 三层精氨酸:电压门控的分子基线
在实现电压依赖性之后,团队进一步想回答一个关键问题:
通道中心那三层精氨酸,到底各自承担什么角色?
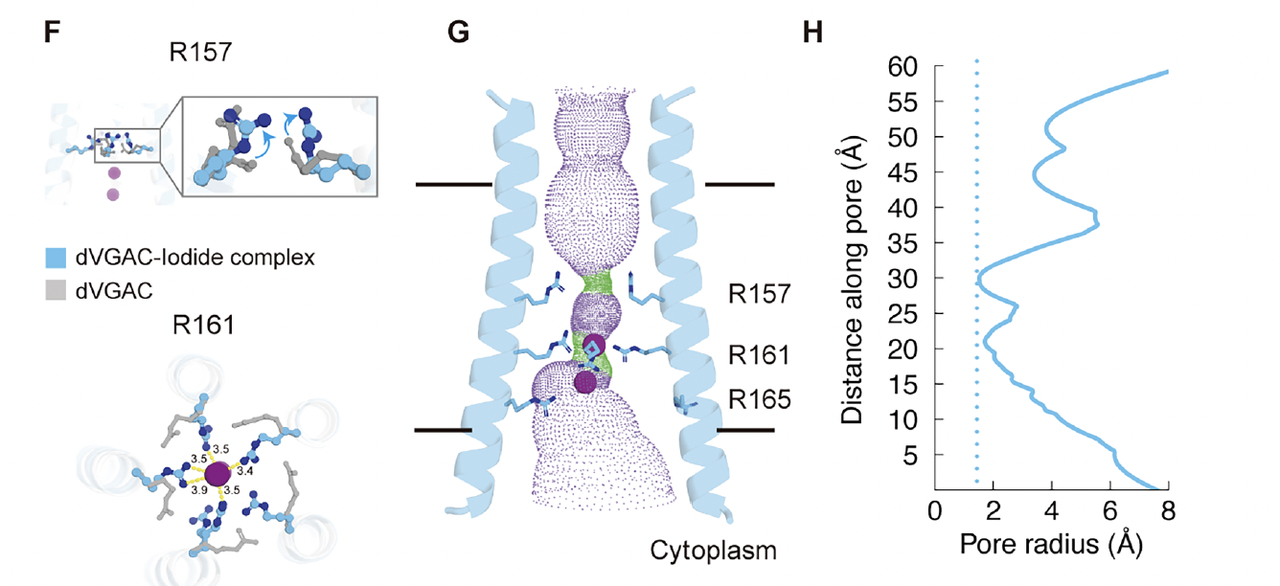
他们依次替换不同位置的精氨酸残基,
比较突变体在电压下的电流响应。
结果清晰而有层次:
R157G(中层):电流显著减弱,电压依赖性几乎消失,说明这一层主导电场感应与开关响应。
R161A(下层):通道失去外向整流特征,阴离子选择性被削弱,提示其参与离子筛选。
R165L(最底层):尽管失去了正电荷,电流曲线几乎与野生型重合,表明该位点主要稳定导电环境而非直接感应电场。
tmZC8-BTB(骨架对照):完全没有可检测电流,验证了电荷层的必要性。
这组实验建立了一个重要认识:
dVGAC 的电压响应不是分布式的偶然现象,而是由精氨酸三层形成的定向电场体系主导的。
上层与中层是“传感器”,下层是“筛选器”,三者协同构成一个高度耦合的“电荷阀门”。
2. 非感电对照:tmZC8-BTB 的结构与动力学
为了验证电压响应确实源自电荷层,研究团队还对不含精氨酸的对照通道 tmZC8-BTB进行了深入表征。
(1)结构层面:稳定但“静默”
Cryo-EM 分辨率 ≈ 3 Å,结构与设计模型 RMSD ≈ 1.2 Å(Fig. 5A–E)。
跨膜螺旋束保持完好、孔径适中(约 3–4 Å),显示这一骨架在膜环境中结构稳定且可折叠。
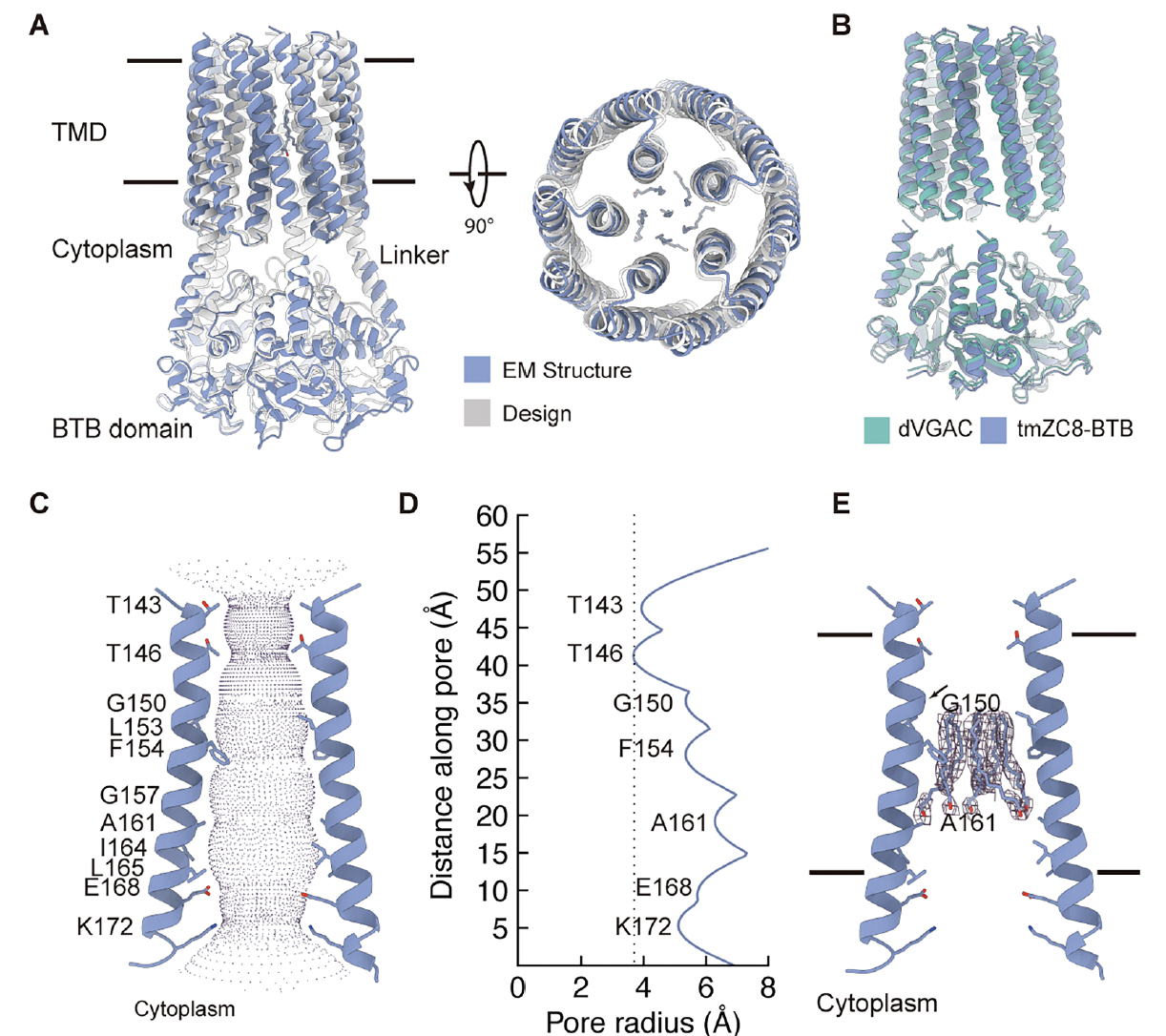
然而,孔道电势几乎中性,缺乏能够感应电场的内部电荷。
换句话说——形态完美,却无法“通电”。
(2)动力学层面:电场下依旧平静
1 μs 分子动力学模拟结果表明(Fig. 5F–I):
RMSD 在 3 Å 左右,无论 0 mV 还是 500 mV 都维持稳定;
Cl⁻ 与 Na⁺ 的穿孔事件极少,
离子在孔道内上下随机震荡,但无净通量。
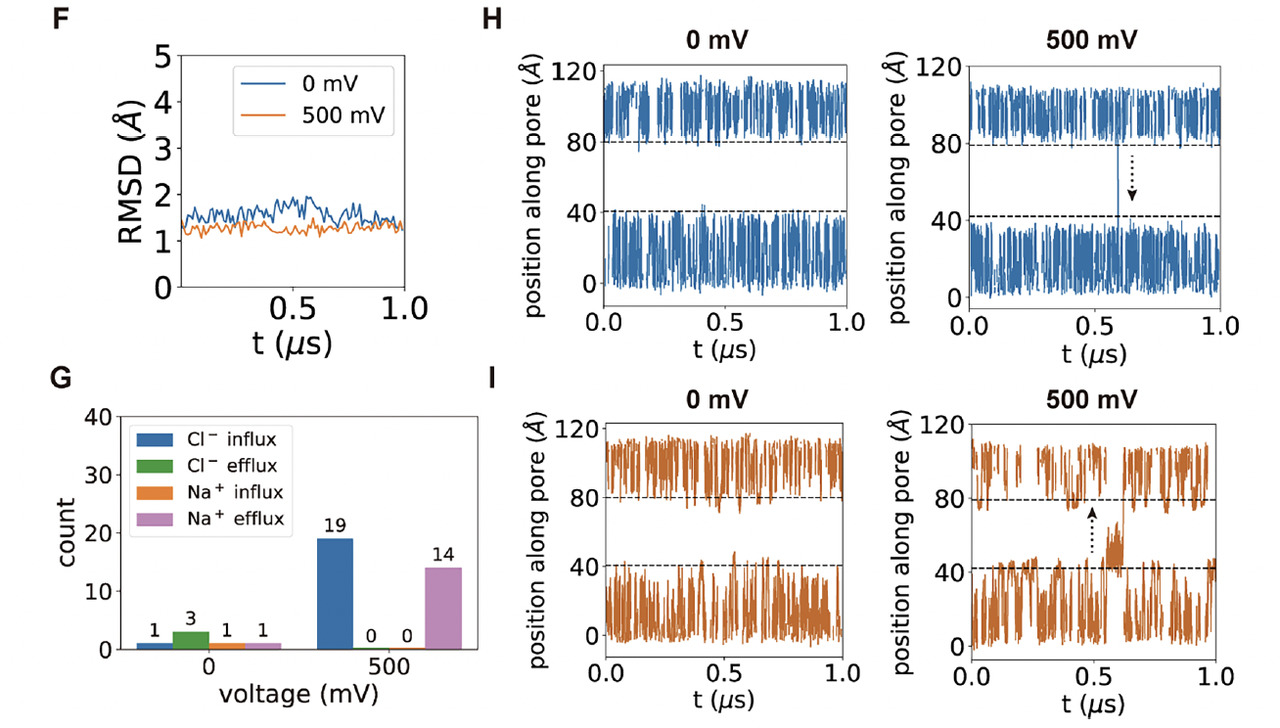
这意味着 tmZC8-BTB 虽然“结构健全”,却完全不响应电压,无法驱动定向离子流。
3. 对照结论:结构稳定性 ≠ 功能可响应
dVGAC 与 tmZC8-BTB 的对比实验构成了整篇论文最有力的论据之一:

这组结果明确指出:
电压门控的核心不是结构本身,而是孔道中心的精氨酸电荷层。
它在膜电场中产生取向变化,构成真正的“电压传感模块”。
4. 小结:从结构设计到机制确认
Figure 4–5 共同完成了机制层面的闭环验证:
通过突变分析揭示“谁在感电”;
通过非感电对照证明“为什么能感电”。
这种逻辑从功能到结构再到动力学的三重验证,
让 dVGAC 的“电荷层门控”机制成为首个经原子级证据支持的人工电压感应模型。
四、功能优化与神经元验证——让人工通道“接入生命电路”
1. dVGAC 的功能确认:真正能“通电”的人工通道
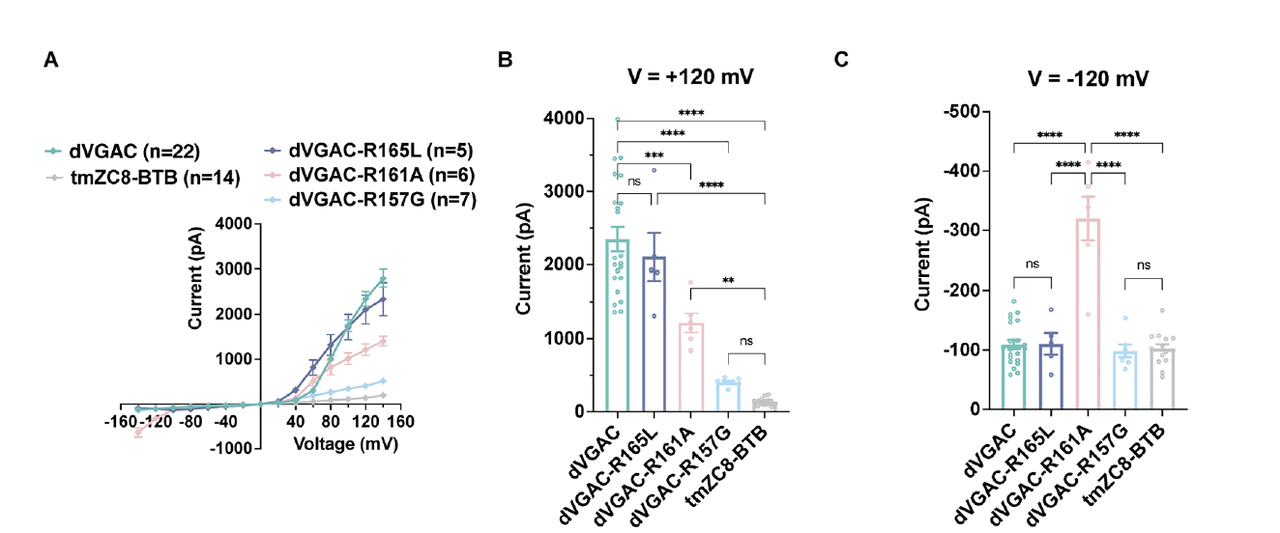
在完成结构与机制验证后,团队首先对 dVGAC 的导电性质进行了系统的电生理测试。
膜片钳结果(Fig.6A–C)显示:
dVGAC 在正电位下表现出显著的电流增加,而对照组 tmZC8-BTB 几乎无响应;
L153R 等结构突变体的电流幅度明显下降,进一步印证了通道中精氨酸分布的关键性。

接着,研究者分析了通道对不同阴离子的选择性(Fig.6D–E)。
结果表明:
dVGAC 对 Cl⁻、Br⁻、NO₃⁻ 离子均具高通透性,但对 F⁻ 几乎不导通。由此推断,孔道内的正电场 是决定阴离子选择性的主要因素。
这一部分确认了:
dVGAC 不仅能稳定嵌入膜中,还具有与天然通道相当的离子导通与选择性特征。
2. 功能优化:R165D 降低激活电位,形成 dVGAC1.0
在理解了通道各层电荷的功能后,团队希望让人工通道的激活阈值进入神经元的生理电压范围。
他们在底层精氨酸(R165)处引入负电突变 R165D,调整孔道中心的静电势分布。
这一版本被命名为 dVGAC1.0。
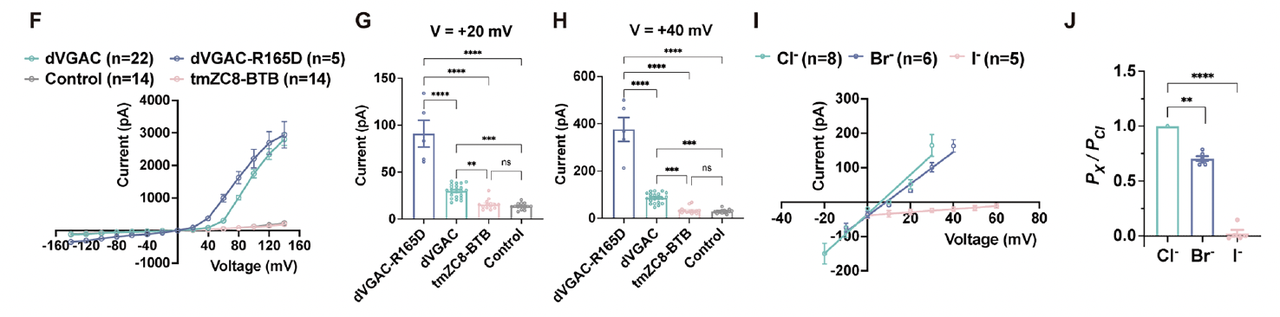
结果令人惊喜:
在 +20 mV 即可触发电流(Fig.6F–H);
电流幅度与响应斜率均高于原型 dVGAC;
离子选择性保持稳定,对 Cl⁻ 优先导通(Fig.6I–J)。
也就是说,R165D 成功将门控阈值降低至神经生理区间,同时保留原有的导电性能——使通道从“能工作”变为“能调控”。
3. 神经元验证:人工通道能抑制放电
为了验证这一功能在生物体系中的可行性,
研究者将 tmZC8-BTB、dVGAC 与 dVGAC1.0
分别通过 AAV 载体表达于小鼠杏仁核(amygdala)的神经元中(Fig.6K–L)。
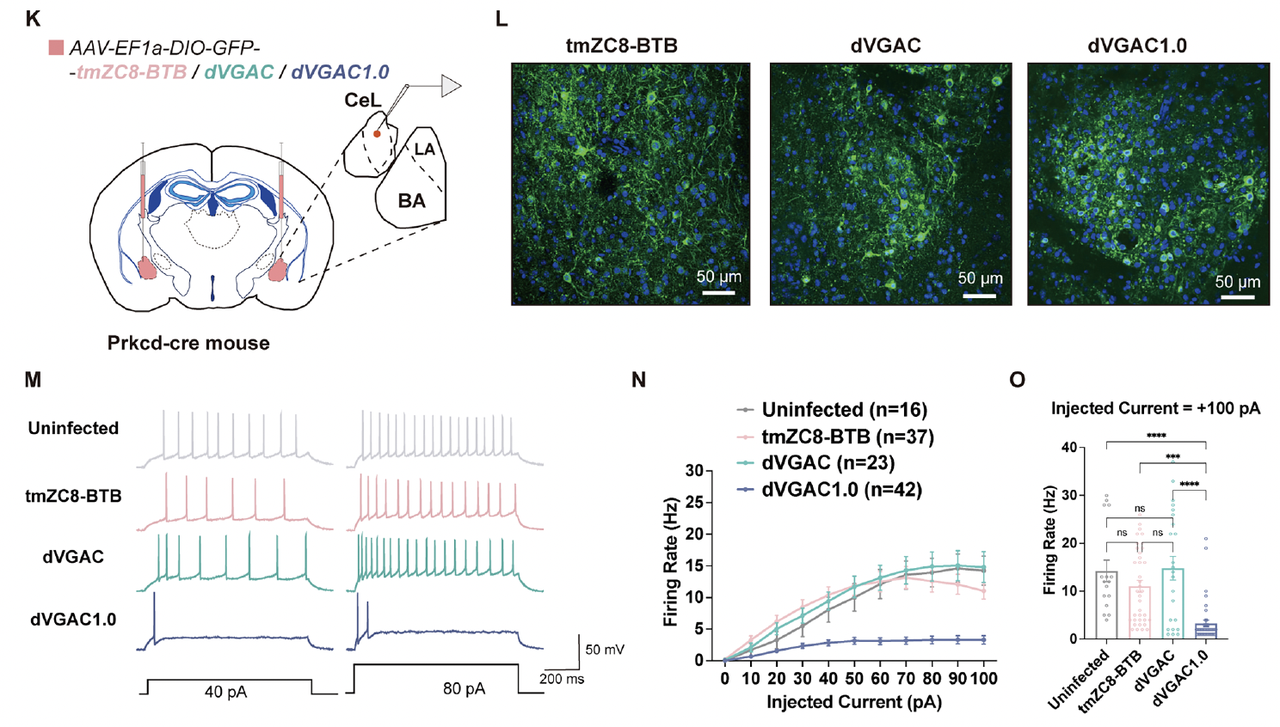
电生理记录(Fig.6M–O)显示:
对照组与 tmZC8-BTB 神经元保持正常放电频率;
表达 dVGAC 的神经元放电受到一定抑制;
而表达 dVGAC1.0 的神经元放电显著减少,
在同样注入电流条件下,动作电位数量下降超过一半。
这些数据表明:
dVGAC1.0 在神经元膜上可被生理电压激活,并通过阴离子导入有效抑制神经兴奋性活动。
4. 小结:从结构功能到生理调控
这一部分的核心成就,是把“设计蛋白”推到了真正的生命层面。

从完全人工的分子,到能响应神经信号的“生物元件”,dVGAC 系列通道首次证明——
电压门控可以被设计、优化,并嵌入生命体系。
这不仅是蛋白设计的突破,更为“人工神经调控”提供了一个分子级的可编程接口。
五、机制模拟——原子级别的“通电瞬间”
1. 研究思路:用计算“看见”通道如何开关
前面通过实验,我们已经知道 dVGAC 确实具有电压门控特性。但科学问题仍然在于:
它究竟是如何响应电场变化的?
电场如何驱动局部结构的变化,从而控制离子通道的开闭?
这些问题在实验上难以直接观察,
于是团队利用长时间尺度的分子动力学模拟(MD)来重建整个过程。
在模拟中,他们对嵌入脂双层的 dVGAC 施加不同强度的跨膜电场,记录氯离子(Cl⁻)在通道内的运动轨迹、孔径变化以及电荷分布演化。
2. 模拟结果:电场触发的“电荷旋转”
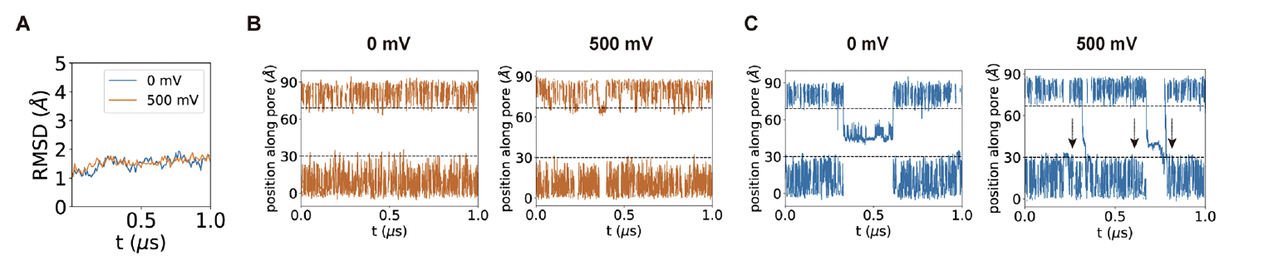
模拟结果非常直观:
当外加电压从 0 mV 升至 500 mV 时,通道中心的三层精氨酸(尤其是 R157 和 R161)的侧链发生明显取向重排——
它们从“收拢”状态逐步旋转,形成一个连续的离子通道通路。
可以看到电荷分布图中,原本集中在通道壁的正电荷在高电压下向孔中心偏移,导致局部静电势能垒下降。
这正是电压门控的微观物理本质:
电场驱动带电残基重排,从而降低离子通道能垒,实现“开门”。
3. 离子流动的时间轨迹:Cl⁻ 的“单分子旅行”
在 1 微秒的模拟中,研究者统计了 Cl⁻ 离子的轨迹分布。
结果显示,在无电场(0 mV)下,离子主要在通道两侧震荡,几乎没有净通量;
而在 500 mV 电压下,Cl⁻ 的轨迹出现连续贯通,沿通道轴线方向穿过三层精氨酸堆叠区(Fig.7D–E)。
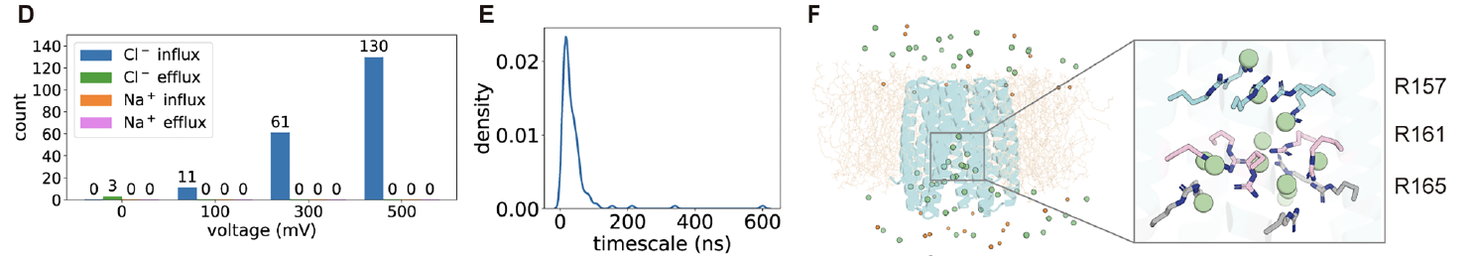
换句话说,在“感电”的瞬间,孔道并没有产生宏观的结构重排,而是通过局部带电侧链的旋转就完成了导通。
这是整个研究中最具象的画面:
一个人工蛋白在电场作用下,像分子机器一样完成了“原子尺度的开关动作”。
4. 机制解析:内源式电压门控的新物理图景
研究者进一步计算了电场方向与离子流速之间的相关性。
结果表明,通道的响应高度对称、快速、可逆:
当电场方向反转时,精氨酸层重新回到“闭合”取向,孔径能垒随之升高,离子流被抑制。
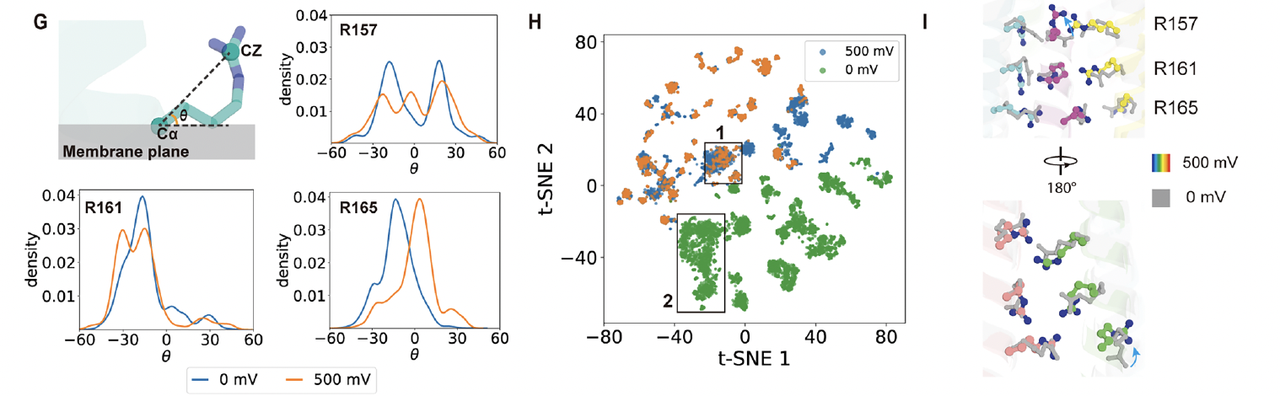
这说明 dVGAC 的电压响应是一个典型的电荷驱动构象平衡过程:
它不依赖复杂的蛋白运动,而是由几对局部氢键与静电相互作用微调完成。
这种机制与天然通道中的 S4 结构域截然不同:
天然通道通过长距离螺旋滑动实现门控;
dVGAC 则通过最小原子尺度的电荷旋转完成同样功能。
这为“电压门控的简化物理模型”提供了首个真实范例。
5. 小结:设计与物理的统一
Figure 7 的分子模拟让整个研究形成了从设计 → 验证 → 机制的闭环。

这一结果清晰地证明:
电压感应并不需要复杂的天然结构域,只需精确布置几个电荷,就能在人工蛋白中重建这一机制。
至此,卢培龙老师团队的工作完成了一个令人震撼的闭环:
从原理推导 → 结构设计 → 实验验证 → 动力学机制。
他们不只是“造出一个能导电的蛋白”,而是展示了如何从物理第一性原理出发,设计出可预测行为的分子机器。
dVGAC 的出现意味着:
人工蛋白不仅可以折叠、结合、发光,
它们还可以感受、响应并调控电信号。
这或许是蛋白质设计真正进入“可编程生命系统工程”的起点。
六、结语:当设计走向思考——从 dVGAC 看蛋白的“第二生命”
1. 从折叠到功能:蛋白设计的第二阶段
过去十年,蛋白设计的目标多停留在“能折叠、能存在”。我们证明了算法可以生成稳定结构,可以模仿天然骨架、创造新的配体结合位点。
而 dVGAC 的意义在于,它第一次证明:
人工蛋白不仅能稳定存在,还能像天然蛋白一样——感知世界,并做出响应。
它会“通电”,会“开关”,会在神经元里抑制信号。这意味着蛋白设计开始迈入第二阶段:从“静态结构”走向“动态功能”。
2. 从模仿自然到重建原理
dVGAC 的突破在于,它没有照搬任何天然模板。
它的门控不依赖传统的 S4 电压感应结构,而是用最少的几层精氨酸,重建了电压响应的物理本质。
这是一种从原理出发的生物设计:
先定义能量与电场的关系,再让分子去实现它。
在某种意义上,这比模仿自然更困难——但也更自由。
它意味着我们正在重写生物功能的构造方式。
不再是“自然给了我们什么”,而是“我们可以创造什么样的自然”。
3. 蛋白质:未来的“电路元件”
当我们能在原子层面设计电压响应,未来的蛋白不再只是“生命分子”,而是信息与能量的接口。
我们或许可以构建出:
可控放电或抑制的人工神经网络;
可与电子系统耦合的生物传感电路;
甚至能根据外部电信号自动调节行为的“活体材料”。
这就是 dVGAC 所代表的未来方向:
从蛋白质设计走向“分子级计算”。
4. 致谢与余韵
这项精彩的工作来自 西湖大学卢培龙老师团队,不仅在技术上跨越了蛋白设计的边界,更在概念上,让“设计”从一种结构生物学实践,变成了一种关于生命本质的物理探索。
在那个跨膜小孔中,我们看到的不只是几根螺旋,而是一种新的问题:
如果生命的功能可以被精确重建,
那生命的“设计”与“自然”之间,
还会有界限吗?
延伸阅读
本文属于 AI4S文献 栏目。
返回 AI4S文献 → 去公众号阅读完整版 →