Nature 重磅综述|合成生物学教父剖析 AI 如何重写蛋白质设计的逻辑
蓝极说:
如果你对蛋白质设计感兴趣,但总觉得门槛太高、不知道从哪开始读起,那么这篇综述正好适合你。

今天看到一篇刚在Cell旗下的Structure杂志上online的综述文章《Code to Complex: AI-driven de novo binder design》 ,感觉写的非常好,可以看作是一本蛋白质设计入门级的“导航图”。
它帮你把蛋白质设计的发展脉络、AI 技术的切入点,以及最新的应用案例串联了起来。读完之后,你能对这个领域有一个系统的“鸟瞰视角”:
蛋白质设计是怎么从实验室里的理性设计,一步步走到今天 AI 驱动的生成模型?
为什么说“binder design”是最具代表性的突破口?
未来它还能在哪些疾病、疗法或者新材料方向发挥作用?
文章的标题 “Code to Complex” 也很有意味:
“Code” 不只是指计算机算法,也是蛋白质序列这套天然的编码语言;
“Complex” 则是目标结合物——新设计出来的蛋白质,精准地抓住它的靶点。
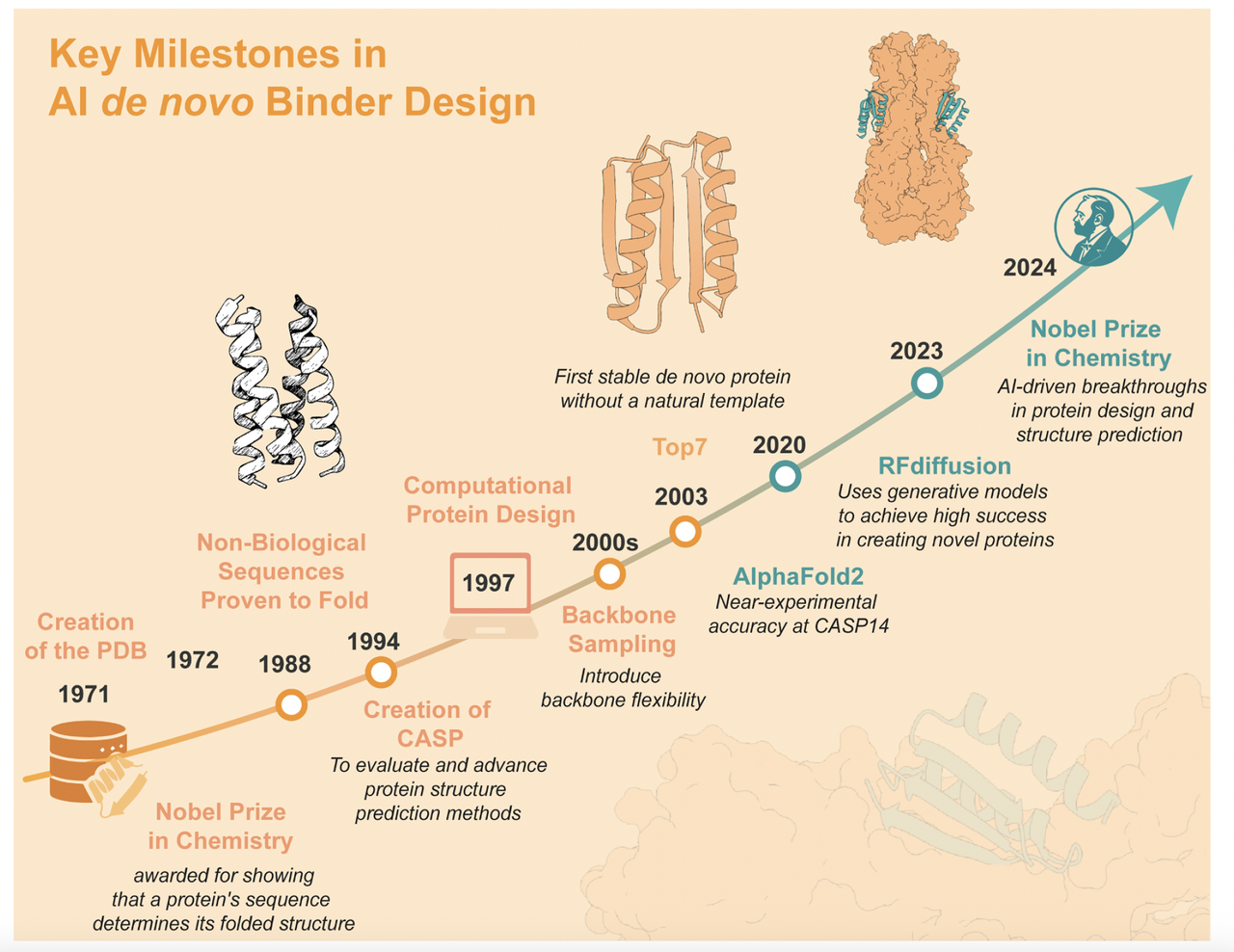
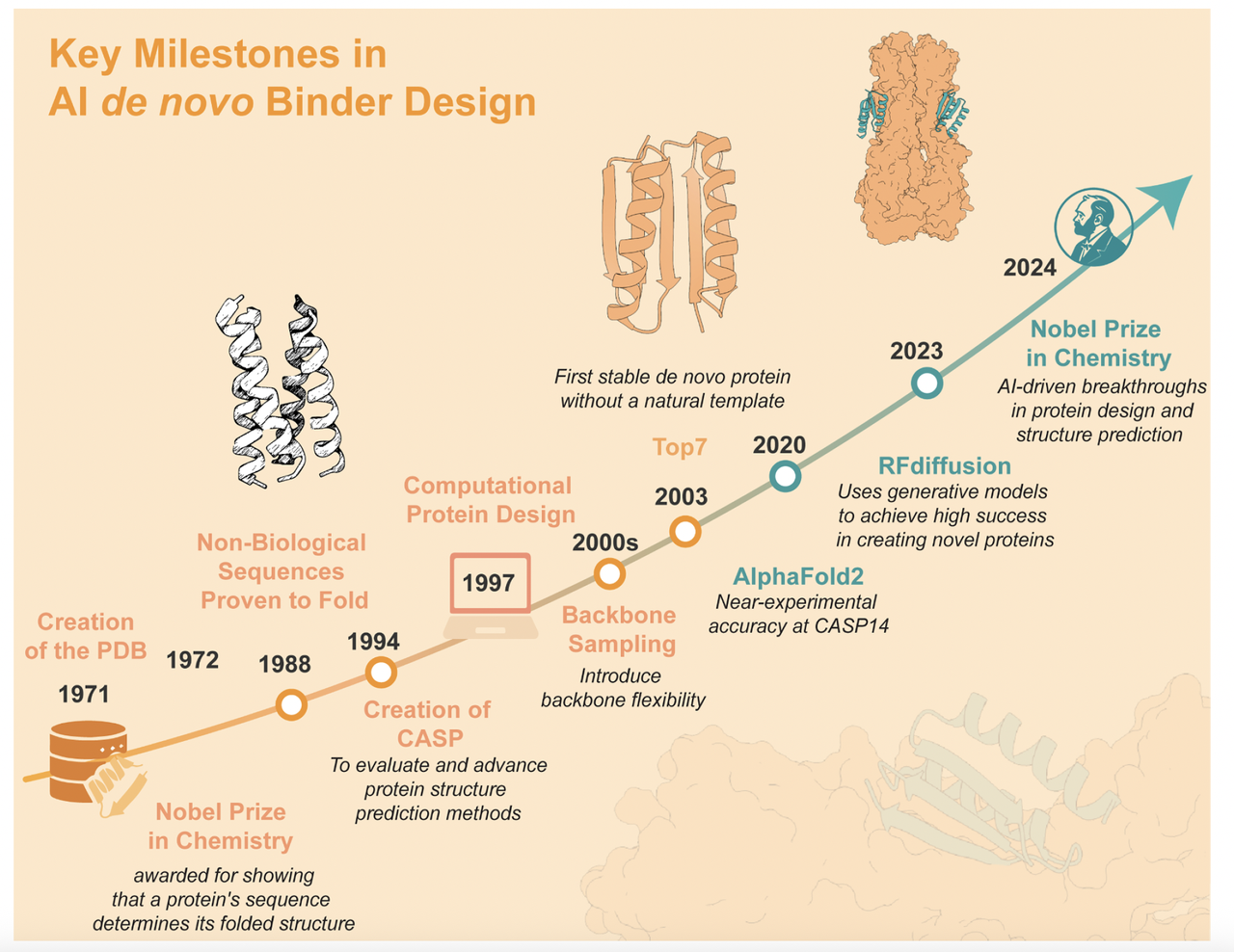
在正文展开之前,作者用一张时间线(Figure 1)作为开场。这张图从1988年第一例人工设计蛋白开始,经过 2003 年的 TOP7、2020 年的 AlphaFold2,一直延伸到 RFdiffusion 等生成式 AI 工具。它告诉我们:
短短几十年,蛋白质设计已经从零散的探索,走到了 AI 主导的全新时代。
二、历史脉络:从能量函数到深度学习
要理解今天的 AI 驱动蛋白质设计,最好先看看它的“进化史”。文章里的 Figure 1 时间线 就像一张导览图,把过去 40 年的关键节点浓缩在一页纸里。
1️⃣ 1988年:理性设计的起点
第一例人工设计的蛋白质——四螺旋束(four-helix bundle)诞生。这是靠着对疏水/亲水规律的理性分析拼出来的,证明了“人造序列也能折叠成稳定结构”。
意义:蛋白质设计不是痴人说梦。
2️⃣ 2003年:TOP7 的突破
Baker 团队设计出了 TOP7,这是第一个完全 de novo(不依赖天然模板)的折叠蛋白。它的出现说明:通过能量函数和计算优化,科学家真的能从零开始写出一个蛋白质。
意义:蛋白质设计从“能折叠”进入“能计算”的阶段。
3️⃣ 2010s:功能性 binder 的探索
随着能量优化和骨架采样方法的改进,研究者开始尝试设计功能性结合蛋白,比如针对流感血凝素的 binder。但效率不高,依赖大量实验筛选。
意义:有功能的蛋白设计出来了,但还很笨重。
4️⃣ 2020–2021年:AlphaFold2 的出现
AlphaFold2 在 CASP14 上达到近似实验的预测精度,彻底改变了结构生物学的格局。它让人们第一次有信心大规模预测并评估设计结果。
意义:AI 把“预测”变得几乎等于“实验”。
5️⃣ 2023–2025年:生成式 AI 工具爆发
RFdiffusion:用扩散模型直接生成蛋白质骨架,再配合 ProteinMPNN 补全序列。
BindCraft:通过共折叠优化设计靶点结合物。
这些方法让 binder 的设计效率提升两个数量级,实验验证成功率达到 7–35%,远超以往。
意义:从“能预测”跨入“能生成”。
整体来看,Figure 1 告诉我们:
蛋白质设计的第一阶段靠“理性规则”;
第二阶段靠“能量优化”;
第三阶段进入“AI 驱动”。
现在的 de novo binder design,已经是这个时间线上的巅峰成果。
三、AI 工具箱:从“幻觉”到“扩散”
如果说早期的蛋白质设计是“摸着石头过河”,那么 AI 出现之后,科学家终于有了一套“工具箱”。文章里提到的几种代表性方法,正好对应了 AI 在蛋白质设计上的逐级进化。
- 幻觉(Hallucination):从预测到生成的第一步

起点是 trRosetta 框架。研究者反向使用结构预测模型:不是给序列预测结构,而是让模型“幻觉”出可能的骨架。
后续发展出了“受限幻觉”(constrained hallucination)和“inpainting”,能把关键的结合基序嵌入到新骨架里。
意义:AI 不只是预测,它能创造全新的蛋白骨架。
- 表面指纹法(MaSIF):让 AI 识别“结合热点”
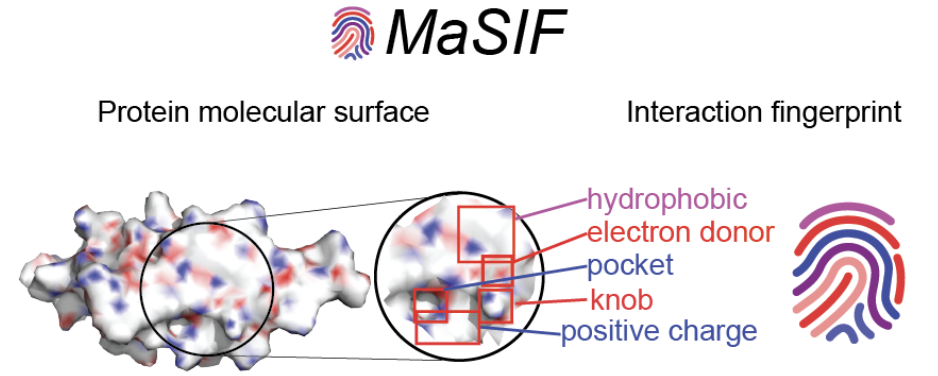
思路是用几何深度学习,直接在蛋白质表面提取“交互指纹”。
再把这些“指纹”嵌到兼容的骨架上,得到能精准贴合靶点表面的 binder。
代表成果包括设计出结合 SARS-CoV-2 spike 蛋白和 PD-L1 的 binder。
意义:AI 开始学会“看懂”靶点表面的几何特征。
- 扩散模型(RFdiffusion):真正的生成引擎
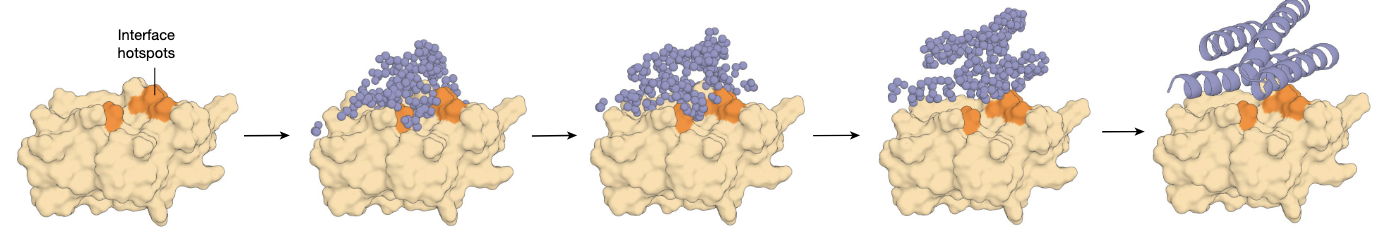
类似 DALL·E 生成图像的方式,RFdiffusion 通过“加噪-去噪”的过程生成蛋白骨架。
配合 ProteinMPNN,在骨架上填充合理的氨基酸序列。
再用 AlphaFold2 评估(pLDDT、RMSD 等指标),筛选出最靠谱的设计。
成功率比过去高出 100 倍,往往只需要几十到上百个设计就能找到高亲和力结合物。

意义:de novo binder 设计进入大规模、实用化阶段。
- BindCraft:考虑靶点的柔性
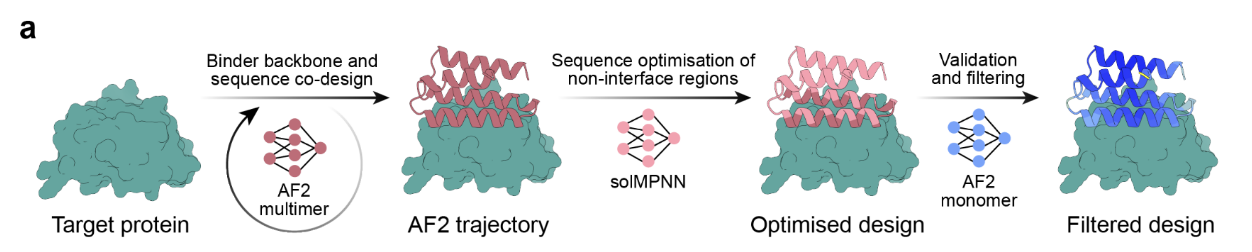
与 RFdiffusion 不同,BindCraft 在生成时会让靶点和设计的 binder 同时“共折叠”。
这样能更好地处理靶点的柔性问题(比如受体的构象变化)。
成功率高到只需 10 个设计就能找到有效 binder。
意义:binder 设计不仅追求“生成”,还要追求“适配”。
结合 Figure 1 的后半部分,这些方法清晰地勾勒出一个趋势:
Hallucination → 打开了“AI 生成”的可能性;
MaSIF → 让 AI 懂得“靶点几何”;
RFdiffusion → 成为当前最强大的通用生成模型;
BindCraft → 向“更接近真实生物环境”的方向演进。
一句话总结:AI 工具箱让设计 binder 不再是少数专家的艺术,而逐渐成为可复用的工程化流程。
四、应用展示:从毒素中和到免疫调控
如果说前面讲的工具和方法还比较抽象,那么文章中的 Figure 2 就让一切变得直观:它把 AI 设计出来的蛋白结合物(binders)的主要应用场景画成了一张全景图。我们可以从中看到,这些小小的人工蛋白,正在从实验室里走向实际的生物医学挑战。
- 毒素中和:人工抗毒血清
案例一:蛇毒 α-神经毒素
研究者利用 RFdiffusion 设计出一批可以紧紧结合蛇毒的 mini 蛋白。在动物实验中,这些人工 binder 在毒蛇咬伤 15 分钟后注射,依然能让小鼠 100% 存活。
相比传统的抗体或抗血清,这些 binder 更小、更稳定、更容易大规模生产。
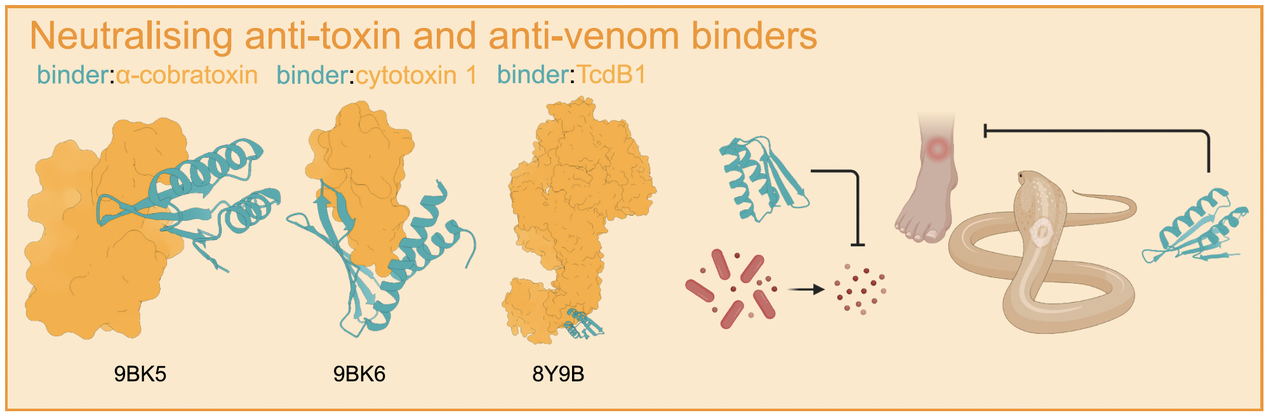
案例二:艰难梭菌毒素B (TcdB)
另一组研究者通过 MotifGraft + docking 的方法,设计出可以同时阻断毒素多个结合位点的迷你蛋白。最后甚至把两个 binder 融合成一个“双特异性小蛋白”,在小鼠肠道模型里表现出良好的保护作用。
显示出 de novo 设计在抗感染领域的巨大潜力。
免疫调控:精准调节免疫反应
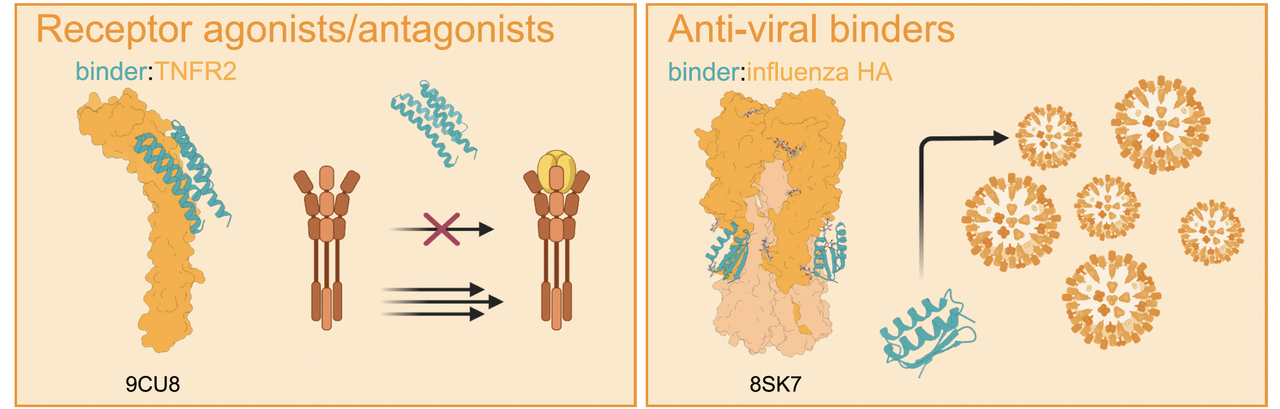
TNFR1 拮抗剂 / TNFR 超家族激动剂
传统抗 TNF-α 药物常常“一刀切”,既抑制有害炎症,也误伤有益信号。AI 设计的 mini binder 可以专门阻断 TNFR1,却不影响 TNFR2;甚至还能通过小改造,让同一类 binder 变成 OX40 或 4-1BB 的激动剂,促进抗癌免疫。
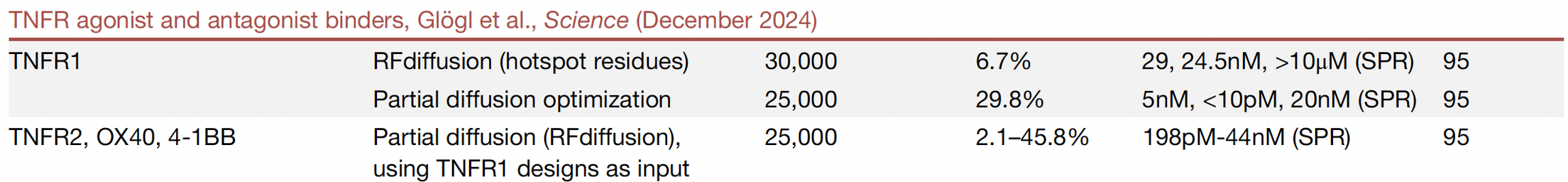
意义在于:AI 可以做出 “定制化免疫开关”。
- IL-23R 与 IL-17A 小蛋白
已经在小鼠炎症性肠病模型里表现出 口服给药有效,并且耐受消化道环境。
意义在于:mini 蛋白不仅能替代注射的抗体疗法,还可能进入口服药物的世界。
- 其他新兴应用
除了毒素和免疫调控,AI binder 的触角已经伸向更多方向:
抗癌:通过设计 pMHC 或 TCR mimic,直接激活 T 细胞杀伤。
抗 CRISPR:设计能阻断 CRISPR 系统的 AI 抑制蛋白,用于基因编辑安全控制。
抗耐药病菌:比如针对铁摄取通道 ChuA 的 binder,可以阻断细菌的营养获取。
诊断与传感:mini 蛋白稳定、可设计性强,非常适合做生物传感器或快速诊断工具。
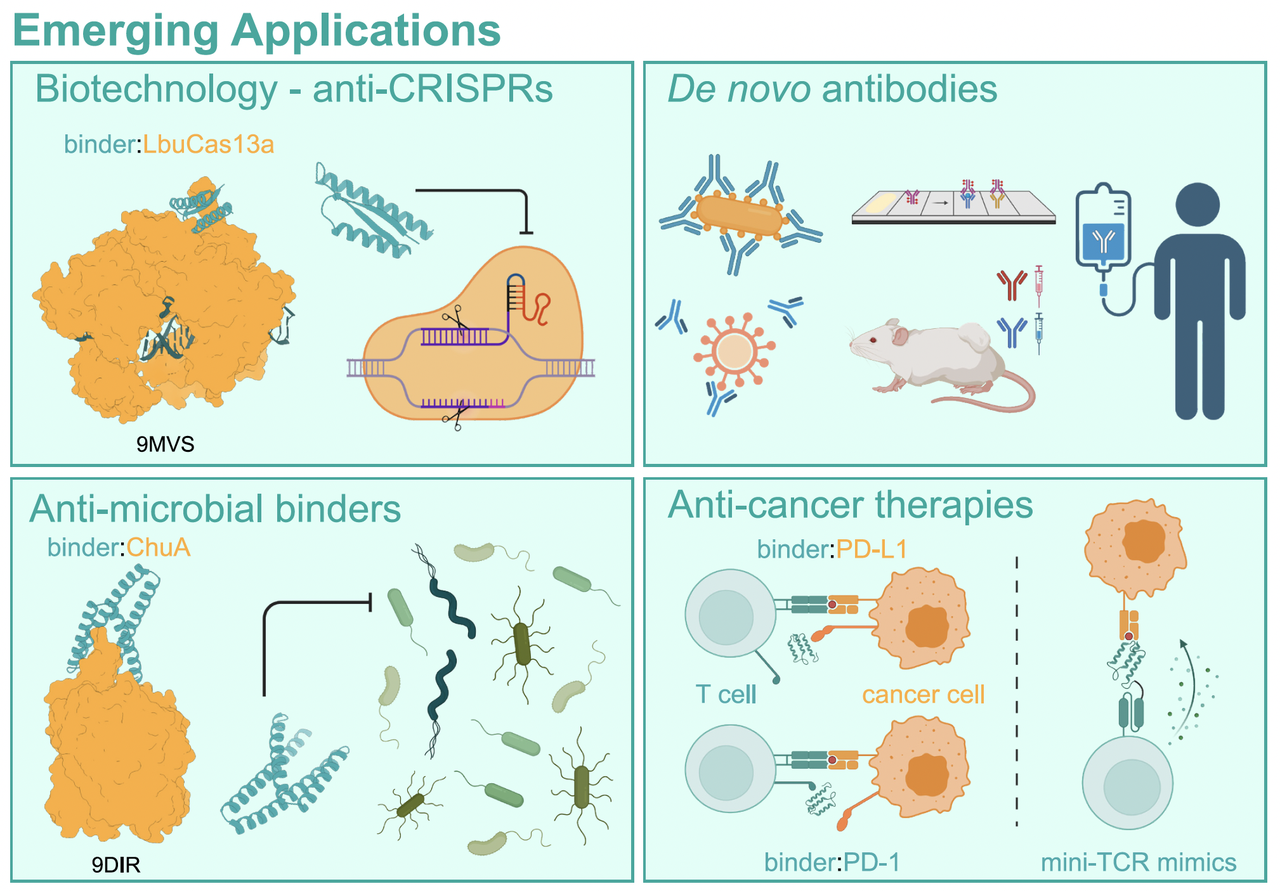
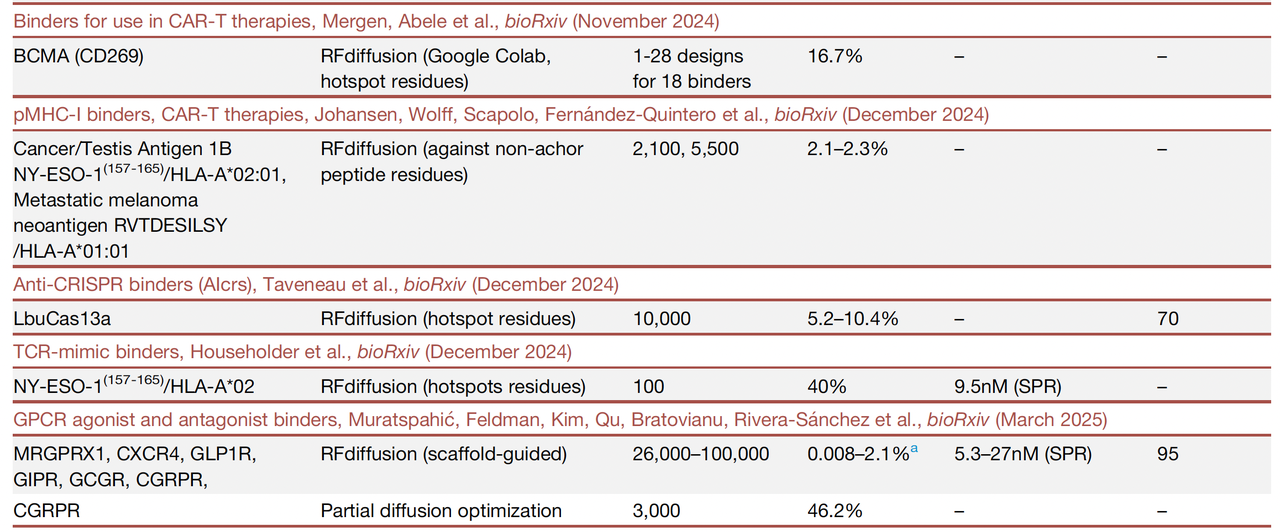
Figure 2 把这些应用串联在一起,让人看到 de novo binder 不再是停留在“能做出来”的科学奇迹,而是正在逐步走向 抗毒、抗癌、免疫治疗、抗感染和诊断等实打实的临床和产业前沿。
一句话总结:AI 设计的 mini 蛋白,正在成为下一代“抗体的替代品”。
五、挑战与展望:不只是技术问题
AI 驱动的 de novo binder 设计听起来无所不能,但文章也很清楚地指出:
从计算到临床,中间还有很多“最后一公里”的障碍。我们可以把它们归纳为四大类挑战。
挑战一: 技术与资源门槛
计算资源瓶颈:训练和运行生成模型需要大量 GPU 算力,这对很多中小实验室来说是“硬门槛”。
专业知识依赖:要用好这些工具,需要既懂结构生物学、又懂深度学习的交叉人才,目前仍很稀缺。
文章提到 ColabFold 等开源平台,算是降低了门槛,让更多人能“在线”运行 AlphaFold2 和 RoseTTAFold,但真正的大规模生成仍受限于算力。
挑战二:预测与现实之间的差距
虽然有 pLDDT、pAE_interaction、RMSD 等筛选指标,但它们和真实结合亲和力之间仍不完全对应。
成功率虽已大幅提高,但并非“必胜公式”。
一个可能的解决方向是:把越来越多的实验数据回流到模型里,帮助 AI 逐步学会“贴近实验现实”。
挑战三:靶点与结构的局限
当前的设计更偏向 α 螺旋结构,β 折叠或更复杂拓扑的设计仍不成熟。
靶点选择上,AI 更擅长对付刚性蛋白,对柔性靶点(比如 GPCR、IDPs)还存在挑战。
不过文章也提到,BindCraft 通过“共折叠”已经在解决靶点柔性的问题,这也是未来的发展方向。
挑战四:转化与伦理考量
免疫原性与递送问题:人工蛋白虽然小而稳定,但仍有可能引发免疫反应;给药方式(口服、注射、mRNA 递送)也需要进一步验证。
伦理与监管:
谁是这些设计的“发明人”?是人类研究者,还是 AI?
技术可能存在“双重用途”:既能救人,也可能被滥用。
文章特别强调:需要新的法律、伦理和监管框架来跟上技术的发展,就像当年 CRISPR 出现时一样。
一句话总结:AI 设计 binder 已经能解决“能不能”的问题,现在需要解决“能不能安全、普及和合规”的问题。
六、结语:范式转变与未来方向
在短短五年时间里,从 AlphaFold2 的横空出世,到 RFdiffusion、BindCraft 等生成模型的成熟,de novo 蛋白质结合物设计已经完成了一次“范式转变”。
过去,科学家要花数年时间才能筛出一个候选分子,如今 AI 能在几天内生成上千个方案,并且实验成功率成倍提升。过去,设计蛋白还是少数顶尖实验室的“手工艺”,现在正在逐渐走向工程化、平台化。
这篇综述的题目 《Code to Complex》 也道出了这个变化:
从序列和算法(Code)出发,
最终实现与靶点精准结合的复合物(Complex)。
未来的问题已经不再是 “AI 能不能设计出蛋白?”,而是 “我们能用它解决哪些现实难题?”。
是抗毒血清?
是口服小蛋白药物?
还是快速应对下一次突发的传染病?
这些可能性都在被逐步打开。可以说,蛋白质设计正在从实验室里的“科学奇迹”,变成现实世界里的“生物工具”。
原文链接:https://doi.org/10.1016/j.str.2025.08.007
延伸阅读
本文属于 AI4S文献 栏目。
返回 AI4S文献 → 去公众号阅读完整版 →